Mentoon
| Hierdie artikel is 'n weesbladsy. Dit is nie geskakel of in ander bladsye ingesluit nie. Help Wikipedia deur na moontlike teks te soek en 'n skakel hierheen te plaas. |
|
Algemeen | |
|---|---|
| Naam | Mentoon |
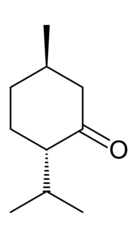
| IUSTC-naam | (2S,5R)-2-Isopropiel-5-metielsikloheksanoon |
 |
|
| Chemiese formule | C10H18O1 |
| Molêre massa | 154.25 g/mol |
| CAS-nommer | 89-80-5 |
| Voorkoms | kleurlose vloeistof |
| Fasegedrag | |
| Smeltpunt | −6 °C |
| Kookpunt | 207 °C |
| Digtheid | 0.895 g/cm³ |
| Oplosbaarheid | |
|
Suur-basis eienskappe | |
| pKa | |
|
Veiligheid | |
| Flitspunt | |
|
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
Mentoon is 'n monoterpeen met 'n mentagtige geur,[1] en wat natuurlik voorkom in 'n aantal eteriese olies. l-Mentoon (of (2S,5R)-trans-2-isopropiel-5-metielsikloheksanoon) is die een van die vier moontlike stereoisomers wat mees algemeen in die natuur voorkom.[2] Dit is struktureel verwant aan mentol, wat 'n sekondêre alkohol in die plek van die karbonielgroep het. Mentoon word in geur, parfuum en skoonheidsmiddels gebruik vir sy kenmerkende aromatiese geur en reuk.
Voorkoms[wysig | wysig bron]
Mentoon is 'n bestanddeel van die eteriese olies van pennyroyal, peperment, Mentha arvensis, Pelargonium malvas, en ander plante. In die meeste gevalle maak dit slegs 'n klein breukdeel van die olie uit, en dit was dus eers deur oksidasie van mentol in 1881 voorberei voordat dit in 1891 in eteriese olies opgespoor is.
Struktuur en voorbereiding[wysig | wysig bron]
2-Isopropiel-5-metielsikloheksanoon het twee asimmetriese koolstofsentrums, wat beteken dat dit in vier verskillende stereoisomere kan voorkom: (2S,5S), (2R,5S), (2S,5R) en (2R,5R). Die S,S en R,R stereoisomere het die metiel- en isopropielgroepe op die dieselfde kant van die sikloheksaan ring: die sogenaamde cis-vorm. Hierdie stereoisomere word isomentone genoem.[3] Die trans-isomere daarenteen, word mentone genoem. Omdat die (2S,5R) isomeer negatiewe optiese rotasie toon, word dit l-mentoon of (-)-mentoon genoem. Dit is die enantiomeer van die (2R,5S) isomeer: (+)- of r-mentoon. Mentoon kan maklik omgeskakel word om na isomentoon en omgekeerd via 'n omkeerbare empimerisasiereaksie via 'n enol tussenvorm. Hiermee verander die rigting van optiese rotasie, sodat l-mentoon verander word in d-isomentoon, en d-mentoon in l-isomentoon.[4]
l-Mentoon kan in die laboratorium voorberei word deur die oksidasie van mentol met aangesuurde dichromaat.[5] As die chroomsuur oksidasie met 'n stoigiometriese hoeveelheid oksidant uitgevoer word in die teenwoordigheid van dietieleter as mede-oplosmiddel, 'n metode wat deur H. C. Brown ontwikkel is, kan die epimerisasie van l-mentoon na d-isomentoon grootliks vermy word. As mentoon en isomentoon by kamertemperatuur geëkwilibreer word, bereik die isomentooninhoud 'n vlak van 29%. Suiwer l-mentoon het 'n intens skoon mentgeur. Daarenteen het d-isomentoon 'n "groen" noot, en hoë vlakke daarvan word beskou as nadelig aan die reukgehalte van l-mentoon.[6]
Geskiedenis[wysig | wysig bron]
Mentoon is vir die eerste keer beskryf deur Moriya in 1881.[7][8] Dit is toe gesintetiseer deur die verhitting van mentol met chroomsuur, en sy struktuur is later bevestig deur dit uit 2-isopropiel-5-metielpimeelsuur.
Mentoon was van kardinale belang by een van die groot meganistiese ontdekkings in organiese chemie. In 1889 het Ernst Beckmann ontdek dat die ontbinding van mentoon in gekonsentreerde swaelsuur 'n nuwe ketoniese materiaal lewer wat 'n gelyke maar teenoorgestelde optiese rotasie teenoor die uitgangsmateriaal toon.[9] Beckmann het besef dat hierdie die gevolg moet wees van 'n inversie van die asimmetriese koolstofatoom langs die karbonielgroep. (Op daardie stadium was daar egter 'n wanopvatting oor die struktuur: Beckman het dus geglo dat die metiel, eerder as die isopropielgroep, langs die karbonielgroep was.) Hy het tereg gepostuleer dat die inversie plaasvind deur middel van 'n intermediêre enol tautomeer, waardeur die asimmetrie van die koolstofatoom tydelik opgehef is deurdat dit verander van 'n tetraëdriese na 'n trigonale (plat) meetkunde. Dit was 'n vroeë voorbeeld van die afleiding van 'n (byna) onopspoorbare tussenproduk in 'n reaksiemeganisme om die uitkoms van die reaksie te verklaar.
Verwysings[wysig | wysig bron]
- ↑ Hirsch, Alan R. (18 Maart 2015). Nutrition and Sensation (in Engels). CRC Press. p. 277. ISBN 9781466569089.
- ↑ Ager, David (21 Oktober 2005). Handbook of Chiral Chemicals, Second Edition (in Engels). CRC Press. p. 64. ISBN 9781420027303.
- ↑ Singh, G. (2007). Chemistry of Terpenoids and Carotenoids (in Engels). Discovery Publishing House. p. 41. ISBN 9788183562799.
- ↑ Kirk-Othmer (27 November 2012). Kirk-Othmer Chemical Technology of Cosmetics (in Engels). John Wiley & Sons. p. 339. ISBN 9781118518908.
- ↑ L. T. Sandborn (1929). "l-Menthone". Org. Synth. 9 (59): 340.
- ↑ Brown, Herbert Charles; Garg, Chandra P.; Liu, Kwang-Ting (1971). "The oxidation of secondary alcohols in diethyl ether with aqueous chromic acid. A convenient procedure for the preparation of ketones in high epimeric purity". J. Org. Chem. 36 (3): 387–390. doi:10.1021/jo00802a005.
- ↑ Moriya, M. (1881). "Contributions from the Laboratory of the University of Tôkiô, Japan. No. IV. On menthol or peppermint camphor". Journal of the Chemical Society, Transactions. 39: 77–83. doi:10.1039/CT8813900077.
- ↑ Read, John (1930). "Recent Progress in the Menthone Chemistry". Chemical Reviews. 7 (1): 1–50. doi:10.1021/cr60025a001.
- ↑ Beckmann, Ernst (1889). "Untersuchungen in der Campherreihe". Annalen. 250 (3): 322. doi:10.1002/jlac.18892500306.
