Nitraat: Verskil tussen weergawes
Content deleted Content added
Jcwf (besprekings | bydraes) No edit summary |
Jcwf (besprekings | bydraes) No edit summary |
||
| Lyn 1: | Lyn 1: | ||
[[Lêer:WOA09 sea-surf NO3 AYool.png|duimnael|Nitraatkonsentrasie in die oseane (2009)]] |
[[Lêer:WOA09 sea-surf NO3 AYool.png|duimnael|links|Nitraatkonsentrasie in die oseane (2009)]] |
||
{{Ioonkas |
|||
{|style="float:left" |
|||
|beeld1=Nitrate-3D-vdW.png |
|||
|- |
|||
| |
|beeld2=Nitrate-ion-2D.png}} |
||
|- |
|||
|[[Lêer:Nitrate-ion-2D.png|100px]] |
|||
|} |
|||
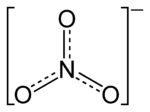
'n Nitraat is 'n [[sout (chemiese stof)|sout]] wat die komplekse anion NO<sub>3</sub><sup>-</sup> of 'n [[ester]] wat die -ONO<sub>2</sub>-groep bevat. Die ioon is die suurres van [[salpetersuur]] HNO<sub>3</sub>. |
'n Nitraat is 'n [[sout (chemiese stof)|sout]] wat die komplekse anion NO<sub>3</sub><sup>-</sup> of 'n [[ester]] wat die -ONO<sub>2</sub>-groep bevat. Die ioon is die suurres van [[salpetersuur]] HNO<sub>3</sub>. |
||
Wysiging soos op 02:02, 25 Maart 2017

|
Algemeen | |
|---|---|
| Naam | Nitraat |
 |
|
| Lys van anione | |
'n Nitraat is 'n sout wat die komplekse anion NO3- of 'n ester wat die -ONO2-groep bevat. Die ioon is die suurres van salpetersuur HNO3.
Die oksidasietoestand van die sentrale stikstofatoom is 5+ (V) en nitrate is oksiderende stowwe wat baie goed in water oplosbaar is.
Ekologie
Ammoniumnitraat is die belangrikste stof in kunsmis. Deur bemesting kan nitrate bydra tot eutrofikasie. Nitrate kan ook deur bemesting ons voedsel besoedel of daaraan toegevoeg word. Nitraat self is nie baie giftig nie, maar bakterië kan dit omsit in nitriet wat giftig is.
