Nitraat: Verskil tussen weergawes
Content deleted Content added
Uitleg van bronteks |
Anioon skakel |
||
| Lyn 5: | Lyn 5: | ||
|term.rad= 2,00(19) Å <ref name="Roobo">''Thermochemical Radii of Complex Ions'' {{Outeur|Helen K. Roobottom, H. Donald B. Jenkins, Jack Passmore, Leslie Glasser}} Journal of Chemical Education 76(11) 1999, bls. 1570</ref> |
|term.rad= 2,00(19) Å <ref name="Roobo">''Thermochemical Radii of Complex Ions'' {{Outeur|Helen K. Roobottom, H. Donald B. Jenkins, Jack Passmore, Leslie Glasser}} Journal of Chemical Education 76(11) 1999, bls. 1570</ref> |
||
|geleibaarheid=71,4 [S.cm<sup>2</sup>/mol]<ref>{{webaanhaling|url=http://www.aqion.de/site/194|titel=aqion}}</ref> }} |
|geleibaarheid=71,4 [S.cm<sup>2</sup>/mol]<ref>{{webaanhaling|url=http://www.aqion.de/site/194|titel=aqion}}</ref> }} |
||
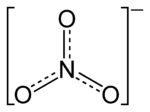
'n Nitraat is 'n [[sout (chemiese stof)|sout]] wat die komplekse anioon NO<sub>3</sub><sup>-</sup> of 'n [[ester]] wat die -ONO<sub>2</sub>-groep bevat. Hierdie ioon is die suurres van [[salpetersuur]] HNO<sub>3</sub>. |
'n '''Nitraat''' is 'n [[sout (chemiese stof)|sout]] wat die komplekse [[Ioon#Anioon|anioon]] NO<sub>3</sub><sup>-</sup> of 'n [[ester]] wat die -ONO<sub>2</sub>-groep bevat. Hierdie ioon is die suurres van [[salpetersuur]] HNO<sub>3</sub>. |
||
Die oksidasietoestand van die sentrale stikstofatoom is 5+ (V) en nitrate is oksiderende stowwe wat baie goed in water oplosbaar is. |
Die oksidasietoestand van die sentrale stikstofatoom is 5+ (V) en nitrate is oksiderende stowwe wat baie goed in water oplosbaar is. |
||
Huidige wysiging sedert 14:55, 12 Mei 2021

|
Algemeen | |
|---|---|
| Naam | Nitraat |
 |
|
| Termochemiese radius | 2,00(19) Å [1] |
| 71,4 [S.cm2/mol][2] | |
| Lys van anione | |
'n Nitraat is 'n sout wat die komplekse anioon NO3- of 'n ester wat die -ONO2-groep bevat. Hierdie ioon is die suurres van salpetersuur HNO3.
Die oksidasietoestand van die sentrale stikstofatoom is 5+ (V) en nitrate is oksiderende stowwe wat baie goed in water oplosbaar is.
Ekologie[wysig | wysig bron]
Ammoniumnitraat is die belangrikste stof in kunsmis. Deur gebruik van hierdie bemesting kan nitrate bydra tot eutrofikasie. Nitrate kan ook deur bemesting ons voedsel besoedel of daaraan toegevoeg word. Nitraat self is nie baie giftig nie, maar bakterië kan dit omsit in nitriet wat giftig is.

