Fosgeen
|
Algemeen | |
|---|---|
| Naam | Fosgeen |
| Ander name | karbonielchloried, koolstofoksichloried |
 |
 |
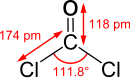
| Chemiese formule | COCl2 |
| Molêre massa | 98,92 [g/mol] |
| CAS-nommer | 75-44-5[1] |
| Voorkoms | Kleurlose gas |
| Reuk | Soetig, verstikkend[1] |
| Fasegedrag | |
| Smeltpunt | -127 °C[1] |
| Kookpunt | 7,55 °C[1] |
| Digtheid | 3,41 (rel lug)[1] |
| Oplosbaarheid | |
|
Suur-basis eienskappe | |
| pKa | |
|
Veiligheid | |
| Flitspunt | Onbrandbaar |
| LD50 | 800 dpm (mens)[1] |
|
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
Fosgeen is 'n chemiese verbinding met formule COCl2. Dit is die suurchloried van koolsuur.
Eienskappe[wysig | wysig bron]
Dié gas is baie giftig en is in die Eerste Wêreldoorlog as chemiese wapen gebruik. Dit word egter ook in die chemiese nywerheid gebruik as grondstof vir die vervaardiging van ander chemiese stowwe, soos metielisosianaat.
Geskiedenis[wysig | wysig bron]
In 1802 het Cruickshank 'n mengsel van gelyke hoeveelhede koolstofmonoksied CO en chloorgas Cl2 in 'n omgekeerde glasfles bo water 'n dag laat reageer. Die volume het gehalveer en die produk het met kalkwater reageer. Cruiskshank het dit nie as fosgeen onderken nie, maar dit het seker gevorm. Later het Murray probeer dit te herhaal, maar dit is John Davy wat in 1811 verklaar het dat dit 'n nuwe gas is. Hy het dit laat reageer met sinc, antimoon, arseen en kalium en het opgemerk dat dit met water vinnig ontbind. Hy het die nuwe gas fosgeen genoem, na die Grieks φως (lig) en γινομαι (vervaardig) omrede hy dit net met lig het kan vervaardig. Schützenberger vind later 'n katalis wat die sintese makliker maak.[2]
Vervaardiging[wysig | wysig bron]
Fosgeen kan ontstaan indien gechlorineerde koolwaterstowwe soos CCl4, CHCl3 of CH2Cl2 bo 400 °C met suurstof reageer.[2]
Die industriële vervaardiging gebeur gewoonlik vanuit koolmonoksied en chloor oor 'n katalis van aktiewe koolstof.
Die reaksie kan baie hitte vrystel en dié hitte moet afgevoer word om te verhoed dat die fosgeen ontbind. Die gas word in staalsilinders gestoor. Oplossings van bytsoda word gebruik om uitstoot van die gas teen te gaan. Bytsoda vernietig fosgeen volgens: [2]
Verwysings[wysig | wysig bron]
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 "BOC gases MSDS" (PDF) (in Engels). Geargiveer vanaf die oorspronklike (PDF) op 18 September 2017. Besoek op 13 Maart 2016.
- ↑ 2,0 2,1 2,2 Phosgene: And Related Carbonyl Halides Deel 24 van Topics in Inorganic and General Chemistry T.A. Ryan, E.A. Seddon, K.R. Seddon, C. Ryan, Elsevier, 1996, ISBN 0080538800, ISBN 9780080538808


