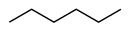
Heksaan
|
Algemeen | |
|---|---|
| Naam | Heksaan |
| IUSTC-naam | Heksaan[1] |
| Ander name | sekstaan[2] heksakarbaan |
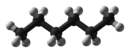 | |
| Chemiese formule | C6H14 |
| Molêre massa | 86,178 g•mol-1 |
| CAS-nommer | 110-54-3 |
| Voorkoms | Kleurlose vloeistof |
| Reuk | petrolagtig |
| Fasegedrag | |
| Smeltpunt | -96 tot -94 °C |
| Kookpunt | 68,5 tot 69,1 °C |
| Digtheid | 0,6606 g•L-1[3] |
| Oplosbaarheid | 9,5 mg•L-1 (in water) |
| Viskositeit | 0,3 mPa•s |
| Termodinamies | |
| ΔfHɵ | −198,0 kJ•mol-1 |
| ΔcHɵ | −4140 kJ•mol-1 |
| Henry se konstante | 7,6 nmol•Pa-1•kg-1 |
| Warmtekapasiteit | 265,2 J•K-1•mol-1 |
|
Suur-basis eienskappe | |
| pKa | |
|
Veiligheid | |
| Flitspunt | −26 °C |
| Selfontbrandingspunt | 234 °C |
| LD50 | 25 g•kg-1 (oraal, rot) |
|
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
Heksaan is 'n organiese verbinding, 'n reguit ketting-alkaan met ses koolstofatome en het die molekulêre formule C6H14.
Heksaan is 'n belangrike bestanddeel van petrol. Dit is 'n kleurlose vloeistof, reukloos as suiwer en met kookpunte van ongeveer 69 °C. Dit word algemeen gebruik as 'n goedkoop, relatief veilige, grootliks onreaktiewe en maklik-verdampte nie-polêre oplosmiddel.
In industrie verwys die term heksane dikwels na 'n mengsel wat grotendeels (>60%) bestaan uit heksaan, met wisselende hoeveelhede van die isomere 2-metielpentaan en 3-metielpentaan, en moontlik kleiner hoeveelhede nie-isomere C5-, C6- en C7-(siklo)alkane. Heksane is goedkoper as suiwer heksaan en word dikwels gebruik in grootskaalse bewerkings wat nie een isomeer benodig nie (bv. As skoonmaakmiddel of vir chromatografie).
Fisiese eienskappe[wysig | wysig bron]
Alle alkane is kleurloos.[4][5] Die kookpunte van die verskillende heksaan-isomere is ietwat eenders, en soos vir ander alkane, is dit meestal laer vir die meer vertakte isomere. Die smeltpunte verskil heeltemal en daar is geen duidelik neiging nie.[6]
Produksie[wysig | wysig bron]
Heksaan word hoofsaaklik verkry deur raffinering van ruolie. Die presiese samestelling van die fraksie hang grootliks af van die bron van die olie (ruwe of gereformeerde) en die beperkings van die raffinering. Die industriële produk (gewoonlik ongeveer 50 gew.% van die reguit-ketting-isomeer) is die fraksie wat teen 65-70 °C kook.
Gebruike[wysig | wysig bron]
In die industrie word heksaan gebruik in die formulering van gom vir skoene, leerprodukte en dakbedekking. Dit word ook gebruik om kookolie (soos canola-olie of soja-olie) uit sade te onttrek, vir die skoonmaak en ontvetting van verskillende artikels en vir die vervaardiging van tekstiele.[7][8]
'n Tipiese laboratoriumgebruik van heksaan is om olie en vetbesoedeling uit water en grond te ontgin vir ontleding.[9] Aangesien heksaan nie maklik gedeprotoneer[Nota 1] kan word nie, word dit in die laboratorium gebruik vir reaksies wat baie sterk basisse insluit, soos die bereiding van organolitiums. Butyllithiums word byvoorbeeld gewoonlik as 'n oplossing in heksaan voorsien.
Heksane word algemeen in chromatografie gebruik as 'n nie-polêre oplosmiddel. Hoër alkane, teenwoordig as onsuiwerhede in heksane, het dieselfde retensietye as die oplosmiddel, wat beteken dat fraksies wat heksaan bevat ook hierdie onsuiwerhede bevat. By voorbereidende chromatografie kan konsentrasie van 'n groot volume heksane 'n monster tot gevolg hê wat merkbaar deur alkane besmet is.
Isomere[wysig | wysig bron]
| Algemene naam | IUSTC-naan | Formule | Skeletformule |
|---|---|---|---|
| heksaaan n-heksaan |
heksaan | CH3(CH2)4CH3 | |
| isoheksaan | 2-metielpentaan | (CH3)2CH(CH2)2CH3 | 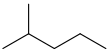
|
| isoheksaan | 3-metielpentaan | CH3CH2CH(CH3)CH2CH3 | 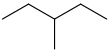
|
| isoheksaan | 2,3-dimetielbutaan | (CH3)2CHCH(CH3)2 | 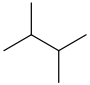
|
| neoheksaan | 2,2-dimetielbutaan | (CH3)3CCH2CH3 | 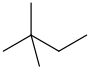
|
Sien ook[wysig | wysig bron]
Aantekeninge[wysig | wysig bron]
- ↑ Deprotonasie (of dehidrogenisering) is die verwydering (oordrag) van 'n proton (of hidron, of waterstofkation), (H+) uit 'n Brønsted-Lowry-suur in 'n suur-basisreaksie.
Verwysings[wysig | wysig bron]
- ↑ "n-hexane – Compound Summary". PubChem Compound (in Engels). USA: National Center for Biotechnology Information. 16 September 2004. Identification and Related Records. Geargiveer vanaf die oorspronklike op 8 Maart 2012. Besoek op 10 Junie 2021.
- ↑ Von Hofmann, August Wilhelm (1 Januarie 1867). "I. On the action of trichloride of phosphorus on the salts of the aromatic monamines". Proceedings of the Royal Society of London (in Engels). 15: 54–62. doi:10.1098/rspl.1866.0018. S2CID 98496840.
- ↑ Haynes, William M. (2016). CRC Handbook of Chemistry and Physics (in Engels) (97th uitg.). Boca Raton: CRC Press. pp. 3–298. ISBN 978-1-4987-5429-3.
- ↑ "Organic Chemistry-I" (PDF) (in Engels). Nsdl.niscair.res.in. Geargiveer vanaf die oorspronklike (PDF) op 29 Oktober 2013. Besoek op 10 Junie 2021.
- ↑ "13. Hydrocarbons | Textbooks" (in Engels). Textbook.s-anand.net. Geargiveer vanaf die oorspronklike op 6 Oktober 2014. Besoek op 10 Junie 2021.}
- ↑ McCain, William D. (1990). The properties of petroleum fluids (in Engels). PennWell. ISBN 978-0-87814-335-1.
- ↑ "The Tofurky Company : Our Ingredients" (in Engels). Tofurky.com. Geargiveer vanaf die oorspronklike op 17 Maart 2015. Besoek op 10 Junie 2021.
- ↑ Palmer, Brian (26 April 2010). "A study found hexane in soy protein. Should you stop eating veggie burgers?". Slate.com. Geargiveer vanaf die oorspronklike op 9 Maart 2015. Besoek op 10 Junie 2021.
- ↑ Use of ozone depleting substances in laboratories (in Engels). Kbh: Nordisk Ministerråd. 2003. ISBN 92-893-0884-2. OCLC 474188215. Geargiveer vanaf die oorspronklike op 16 Julie 2012. Besoek op 10 Junie 2021.
{{cite book}}: CS1 maint: bot: original URL status unknown (link)