Molibdaat: Verskil tussen weergawes
Jcwf (besprekings | bydraes) Nuwe bladsy geskep met '{{Ioonkas |beeld1=Molybdate.png |beeld2=Molybdate 3D.png<!-- |term.rad=2,18 Å <ref name="Roobo">''Thermochemical Radii of Complex Ions'' {{Outeur|Helen K. Roobottom, H. Donald B. Jenkins, Jack Passmore, Leslie Glasser}} Journal of Chemical Education 76(11) 1999, bls. 1570</ref> |geleibaarheid=160,7 [Scm<sup>2</sup>/mol]<ref>{{webaanhaling|url=http://www.aqion.de/site/194|titel=aqion}}</ref>--> }} In die chemie is 'n '''molibdaat''' 'n verbinding w...' |
(Geen verskil)
|
Wysiging soos op 03:28, 16 Mei 2024
|
Algemeen | |
|---|---|
| Naam | Molibdaat |
 |

|
| Lys van anione | |
In die chemie is 'n molibdaat 'n verbinding wat 'n oksianioon bevat met molibdeen in sy hoogste oksidasietoestand van +6: O−−Mo(=O)2−O−. Dit kan 'n sout of 'n ester betref.
Molibdeen kan 'n baie groot reeks van sulke oksianione vorm, wat diskrete strukture of polimeries verlengde strukture kan wees, alhoewel laasgenoemde slegs in die vaste toestand voorkom. Die groter oksianione is lede van 'n groep verbindings wat polioksometalate genoem word. Omdat hulle slegs een tipe metaalatoom bevat, word dit dikwels isopolimetalate genoem..[1] Die diskrete molibdeenoksianione wissel in grootte van die eenvoudigste MoO2−4, soos in natriummolibdaat tot uiters groot strukture wat in isopolimolibdeenblou gevind word. Dit bevat byvoorbeeld 154 Mo-atome. Wolfram is soortgelyk aan molibdeen en vorm baie wolframate wat sesvoudig gekoöordineerde wolframatome bevat.[2]
Voorbeelde van molibdaatanione
Voorbeelde van molibdaatoksianione is:
- (mono) MoO2−4, in e.g. Na2MoO4 en het mineraal powelliet, CaMoO4;
- (di) Mo2O2−7, soos in gehidrateerde ammoniumdimolibdaat. Die watervrye tetrabutielammoniumsout van Mo2O2−7 is ook bekend;[3]
- (tri) Mo3O2−10 kom in die etilenediamiensout voor;[4]
- (tetra) Mo4O2−13 word in 'n kaliumsout aangetref;[5]
- (penta) Mo5O2−16 in het sout van anilien (C6H5NH+3);[6]
- (heksa) Mo6O2−19 in die tetrametielammoniumsout;[7]
- (hepta) Mo7O6−24 in ammoniumheptamolibdaat, (NH4)6Mo7O24·4H2O;[8]
- (okto) Mo8O4−26 in die trimetielammoniumsout.[1]
Die benaming van molibdate volg gewoonlik die konvensie van 'n voorvoegsel om die aantal Mo-atome aan te dui. Byvoorbeeld, dimolibdaat vir 2 molibdeenatome; trimolibdaat vir 3 molibdeenatome, ens. Soms word die oksidasietoestand as 'n agtervoegsel bygevoeg, soos in pentamolibdaat(VI). Die heptamolibdaatioon, Mo7O6−24, word dikwels "paramolibdaat" genoem.
Struktuur van molibdaatanione
Die kleiner anione, MoO2−4 en Mo2O2−7 het tetraëdriese omringing. In MoO2−4 is die vier suurstofatome ekwivalent soos in sulfaat en chromaat, met gelyke bindingslengtes en -hoeke. Mo2O2−7 kan beskou word as twee tetraëders wat 'n hoek deel, dit wil sê met 'n enkele oorbruggende O-atoom.[1] In die groter anione is molibdeen oor die algemeen, maar nie eksklusief nie, 6-voudig gekoördineer met kante of hoekpunte van MoO6-oktaëders wat gedeel word. Die oktaëders is verwronge. Tipiese M-O-bindingslengtes is:
- in terminaal nie-oorbruggende M–O ongeveer 170pm.
- in oorbruggende M–O–M-eenhede ongeveer 190pm.
Die Mo8O4−26-anioon bevat beide oktaëdriese en tetraëdriese molibdeen en kan geïsoleer word in 2 isomere vorms, alfa en beta.[2]
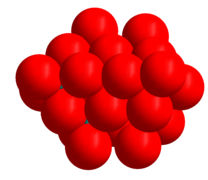
Die heksamolibdaat-beeld hieronder toon die koördinasie-poliëders. Die spasievullende model van die heptamolibdaat toon die diggepakte aard van die suurstofatome in die struktuur. Die oksiedioon het 'n ioniese radius van 140pm; molibdeen(VI) is baie kleiner, 59pm.[1] Daar is sterk ooreenkomste tussen die strukture van die molibdate en die molibdeenoksiede, (MoO3, MoO2 en die oksiede Mo9O26 en Mo10O29) wat se strukture almal diggepakte oksiedione bevat.[9]
-
(a) Heksamolibdaat [Mo6O19]2− (b) Heptamolibdaat [Mo7O24]6−
-
Bal-en-stokmodel van heptamolibdaat
-
Heptamolibdaat with ruimtevullende suurstofatome
Ewewigte in waterige oplossing
Wanneer MoO3, molibdeentrioksied in alkalioplossing opgelos word, word die eenvoudige MoO2−4 anioon geproduseer:
As die pH verlaag word, volg kondensasie, met verlies van water en die vorming van Mo–O–Mo-bindings. Die stoïgiometrie wat lei tot heksa-, hepta- en oktamolibdate word getoon:[1][10]
Peroksomolibdate
Baie peroksomolibdate is bekend. Hulle is geneig om te vorm wanneer molibdaatsoute met waterstofperoksied behandel word. Opmerklik is die monomeer-dimeer-ewewig:
[Mo(O2)4]2− is ook bekend maar dit is onstabiel. Sommige verwante verbindings vind gebruik as oksideermiddels in organiese sintese.[11]
Industriële gebruike
Katalise
Molibdate word wyd gebruik in katalise. Die grootste verbruiker van molibdaat is die vervaardiging van katalisators vir hidro-ontzwaveling, die proses waardeur swael uit petroleum verwyder word. Bismutmolibdate, nominaal van die samestelling Bi9PMo12O52, kataliseer ammoksidasie van propileen tot akrilonitriel. Ferrimolibdate word industrieel gebruik om die oksidasie van metanol na formaldehied te kataliseer.[12]
| Hierdie artikel is in sy geheel of gedeeltelik vanuit die Engelse Wikipedia vertaal. |
Verwysings
- ↑ 1,0 1,1 1,2 1,3 1,4 Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd uitg.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ↑ 2,0 2,1 2,2 2,3 Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (1999). Advanced Inorganic Chemistry (6th uitg.). New York: Wiley-Interscience. ISBN 0-471-19957-5.
- ↑ V. W. Day; M. F. Fredrich; W. G. Klemperer; W. Shum (1977). "Synthesis and characterization of the dimolybdate ion, Mo2O2−7". Journal of the American Chemical Society. 99 (18): 6146. doi:10.1021/ja00460a074.
- ↑ Guillou N.; Ferey G. (Augustus 1997). "Hydrothermal Synthesis and Crystal Structure of Anhydrous Ethylenediamine Trimolybdate (C2H10N2)[Mo3O10]". Journal of Solid State Chemistry. 132 (1): 224–227(4). Bibcode:1997JSSCh.132..224G. doi:10.1006/jssc.1997.7502.
- ↑ B. M. Gatehouse; P. Leverett (1971). "Crystal structure of potassium tetramolybdate, K2Mo4O13, and its relationship to the structures of other univalent metal polymolybdates". J. Chem. Soc. A: 2107–2112. doi:10.1039/J19710002107.
- ↑ W. Lasocha; H. Schenk (1997). "Crystal Structure of Anilinium Pentamolybdate from Powder Diffraction Data. The Solution of the Crystal Structure by Direct Methods Package POWSIM". J. Appl. Crystallogr. 30 (6): 909–913. doi:10.1107/S0021889897003105.
- ↑ S. Ghammami (2003). "The crystal and molecular structure of bis(tetramethylammonium) hexamolybdate(VI)". Crystal Research and Technology. 38 (913): 913–917. doi:10.1002/crat.200310112. S2CID 95078211.
- ↑ Howard T. Evans jr.; Bryan M. Gatehouse; Peter Leverett (1975). "Crystal structure of the heptamolybdate(VI)(paramolybdate) ion, [Mo7O24]6−, in the ammonium and potassium tetrahydrate salts". J. Chem. Soc., Dalton Trans. (6): 505–514. doi:10.1039/DT9750000505.
- ↑ "Oxides: solid state chemistry" W.H. McCarroll, Encyclopedia of Inorganic Chemistry Ed. R. Bruce King, John Wiley and Sons (1994) ISBN 0-471-93620-0
- ↑ Klemperer, W. G. (1990). "Tetrabutylammonium Isopolyoxometalates". Inorganic Syntheses. Inorganic Syntheses. Vol. 27. pp. 74–85. doi:10.1002/9780470132586.ch15. ISBN 9780470132586.
- ↑ Dickman, Michael H.; Pope, Michael T. (1994). "Peroxo and Superoxo Complexes of Chromium, Molybdenum, and Tungsten". Chem. Rev. 94 (3): 569–584. doi:10.1021/cr00027a002.
- ↑ Roger F. Sebenik et al. "Molybdenum and Molybdenum Compounds" in Ullmann's Encyclopedia of Chemical Technology 2005; Wiley-VCH, Weinheim. doi:10.1002/14356007.a16_655

![(a) Heksamolibdaat [Mo6O19]2− (b) Heptamolibdaat [Mo7O24]6−](http://upload.wikimedia.org/wikipedia/commons/thumb/9/9c/Polyederstrukturen_Molybd%C3%A4n.png/417px-Polyederstrukturen_Molybd%C3%A4n.png)


![{\displaystyle {\ce {6 [MoO4]^2- + 10 HCl -> [Mo6O19]^2- + 10 Cl- + 5 H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6c7e460523b6c3300811b23faa0595a372be2c04)


![{\displaystyle {\ce {[Mo2O3(O2)2(H2O)2]^2- <=> [Mo2O3(O2)4(H2O)2]^2-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/75670ef6b00c8c1655975c07b5436ee08ec092fe)