Stereo-isomeer
Stereo-isomere is stowwe met dieselfde atomiese samestelling en met dieselfde bindings, wat egter in hul driedimensionale struktuur verskil. Daar is twee tipes: cis-trans-isomere en chirale stereo-isomere.[1]
Cis-transisomerie[wysig | wysig bron]
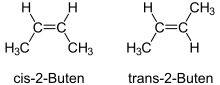
'n Enkele C-C-binding is vrylik draaibaar, maar vir 'n dubbele binding is dit nie die geval nie. Dit wil sê dat die molekuul H3C-HC=CH-CH3 (2-buteen) in twee weergawes voorkom, wat (effens) verskillende eienskappe het. Hierdie tipe isomerie is belangrik in biologie en selfs vir gesondheid. Onversadigde vetsure kom in die natuur gewoonlik in die cis-vorm voor. Industriële bewerking soos hidrogenasie kan die een vorm egter omskakel na die ander een, en trans-vette is skadelik vir die gesondheid van die mens.[2]
Cis-transisomerie kom ook by metaalkomplekse voor en kan met Kurnakov se reaksie onderskei word.
Chirale stereo-isomerie[wysig | wysig bron]
Enantiomere[wysig | wysig bron]
- Die hoofartikel vir hierdie afdeling is: enantiomeer.


'n Goeie voorbeeld van hierdie tipe isomerie uit die daaglikse lewe is 'n paar skoene. Hul het dieselfde samestelling uit dieselfde materiale, maar die een is die spieëlbeeld van die ander. Indien 'n molekuul nie self die simmetrie van 'n spieëlvlak besit nie, is daar ook 'n linker- en 'n regterweergawe van die molekuul. 'n Goeie voorbeeld is die molekuul CFClBrH. Dit het 'n tetraëdriese struktuur maar die vier hoeke (die ligande) word beset deur vier verskillende atome. Die molekuul bestaan in twee stereo-isomere wat mekaar se spieëlbeelde is. Die verskynsel word chiraliteit genoem en die twee isomere word enantiomere van mekaar genoem.
Dit is in teenstelling met 'n molekuul soos CF2ClBr met slegs drie verskillende ligande. So 'n molekuul het wel 'n inwendige spieëlvlak en kom slegs in een weergawe voor. (Die spieëlvlak loop deur die Cl-C-Br atome en spieël die een fluooratoom af op die ander een.)
Die ontdekking van chirale stereo-isomere[wysig | wysig bron]

'n 50/50 mengsel van albei stereo-isomere word 'n rasemiese mengsel genoem. Indien die stereo-isomere van 'n rasemiese mengsel kristalliseer, pak hulle soms saam in aparte kristalle wat dan dikwels ook spieëlbeeldige vorme aanneem. Wynsteensuur is 'n beroemde voorbeeld daarvan wat eintlik tot die ontdekking van chiraliteit gelei het.
Optiese aktiwiteit[wysig | wysig bron]
Indien 'n bundel lig wat linêer gepolariseerd is deur 'n vloeistof soos water gestuur word, sal gewoonlik die polarisasierigting dieselfde blyf, maar indien dit byvoorbeeld 'n oplossing van suiker betref, sal die polarisasierigting draai. Die hoek waaroor die rigting verdraai raak, hang van die padlengte, die suikerkonsnsentrasie en die golflengte van die lig af. Hierdie effek word optiese aktiwiteit genoem en dit word in die suikernywerheid gebruik om suikerkonsentrasies te meet. Die meetinstrument word polarimeter genoem.

In 1844 het 'n Duitse chemicus, Eilhard Mitscherlich, ontdek dat 'n rasemiese oplossing van natriumammoniumtartraat, 'n sout van wynsteensuur, nie die rigting van gepolariseerde lig beïnvoed nie, maar dat 'n oplossing met net een stereo-isomeer dit wel doen. Optiese aktiwiteit word dus deur die teenwoordigheid van net een enantiomeer veroorsaak. Mitscherlich het nogtans geen verskille in samestelling of molêre massa gevind nie en het hy dit nie verstaan nie. Vier jaar later het Louis Pasteur opnuut hierdie probleem nagevors. Hy het die voordeel van Jean-Bapiste Biot se werk gehad wat optiese aktiwiteit verder ondersoek het, en wat opgemerk het dat dit moeilik te verstane was hoe molekules met verskillende eienskappe geen verskillende struktuur of vorm sou hê nie. Pasteur het die kristalle van die rasemiese tartraat opnuut onder die mikroskoop gelê en gesien dat ook die kristalle 'n linkse en 'n regse vorm gehad het. Die kristalle is dihedraal, wat wil sê dat hulle 'n klein vlak aan een kant van hul bokant het. Pasteur het gesien dat die posisie van die klein vlakkie verskillend was. Pasteur het toe gepoog om kristalle uit te pik en só op moeisame wyse te skei. 'n Oplossing van die geskeide kristalle vertoon optiese aktiwiteit, en wel in teenoorgestelde rigtings vir die twee stereo-isomere.[3]
Verwysings[wysig | wysig bron]
- ↑ Frederick Bettelheim et al. Introduction to General, Organic and Biochemistry, 2013, 2016, ISBN 978-1-285-86975-9 Hoofstuk 15: Chirality
- ↑ Robert DeMaria, Laura A. Meyer Dr. Bob's Trans Fat Survival Guide, 2005, ISBN 0-9728907-2-6
- ↑ Seymour Mauskopf "A history of chirality" in Chiral Analysis, 2006, ISBN 978-0-444-51669-5
