Oplossing (chemie)

In chemie is 'n oplossing 'n homogene mengsel wat saamgestel word uit twee of meer stowwe. In so 'n mengsel word die opgeloste stof opgelos in 'n ander stof, wat die oplosmiddel genoem word.
Verskillende soorte oplossings
[wysig | wysig bron]Gewoonlik word die element of stof waarvan die grootste hoeveelheid teenwoordig is as die oplosmiddel gesien. Oplosmiddels kan gasse, vloeistowwe, of vastestowwe wees. Die oplossing wat vorm het dieselfde fisiese toestand as die oplosmiddel. Opgeloste stowwe kan ook gasse, vloeistowwe, of vastestowwe wees.
Gas
[wysig | wysig bron]Slegs gasse los op in alle moontlike fisiese toestande. 'n Voorbeeld van 'n oplossing in gas is lug (suurstof en ander gasse opgelos in stikstof). Aangesien interaksies tussen molekules byna geen rol speel nie, vorm opgeloste gasse triviale oplossings. Gasse is in mekaar mengbaar, met sekere uitsonderings bo die kritieke punt. Reaksies is steeds moontlik in die gasfase, soos by ammoniak en chloorgas:
Indien hierdie gasse by mekaar gevoeg word, ontstaan ammoniumchloried, wat 'n vaste stof is, en as 'n digte "rook" waargeneem kan word.
Gasmengsels kan ook plofbaar wees, soos waterstof en suurstof. 'n Vonk kan dit tot ontploffing bring:
Vloeistowwe
[wysig | wysig bron]Indien die oplosmiddel 'n vloeistof is sal gasse, vastestowwe en ander vloeistowwe daarin oplos. Voorbeelde hiervan is:
Gas in vloeistof
[wysig | wysig bron]- Suurstof in die water
- Koolstofdioksied in water is 'n minder eenvoudige voorbeeld, aangesien die oplossing vergesel word deur 'n chemiese reaksie (die vorming van ione). Let ook op dat die sigbare borrels in die water nie die opgeloste gas is nie, maar slegs 'n opbruising, die opgeloste gas self is nie sigbaar nie omdat dit ontbind op 'n molekulêre vlak.
Die oplosbaarheid van gasse in 'n vloeistof kan dikwels goed met Henry se wet beskryf word.
Vloeistof in vloeistof
[wysig | wysig bron]- Alkoholiese drank is basies oplossings van etanol in water
- Petroleum is 'n oplossing van verskeie koolwaterstowwe
Indien die twee vloeistowwe chemies baie op mekaar lys, kan die oplossing soms as 'n ideale oplossing met Raoult se wet beskryf word. Indien hulle meer verskil kan dalk in 'n verdunde oplossing steeds Raoult se wet vir die oplosmiddel (die meerderheidskomponent) gebruik word, maar die opgeloste stof vereis dikwels Henry s'n.
Vastestof in vloeistof
[wysig | wysig bron]- Sukrose (tafel suiker) in water
- Natriumchloried of enige ander sout in die water vorm 'n elektroliet. Wanneer opgelos, dissosieer sout in ione wat 'n elektriese stroom sal gelei
Liggaamsvloeistowwe is voorbeelde van komplekse vloeibare oplossings, met baie verskillende opgeloste stowwe. Hulle is elektroliete omdat hulle opgeloste ione bevat (bv. kalium en natrium). Verder bevat hulle opgeloste molekules soos suiker en ureum. Suurstof en koolstofdioksied is ook 'n noodsaaklike komponent van bloedchemie, waar beduidende veranderinge in hul konsentrasies 'n teken van siekte of besering is.
Vastestowwe
[wysig | wysig bron]Indien die oplosmiddel 'n vastestof is sal gasse, vloeistowwe en ander vastestowwe daarin oplos. Voorbeelde hiervan is:
- Gas in vastestof:
- Waterstof los nogal goed op in metale, veral in palladium.
- Vloeistof in vastestof:
- Kwik los in goud op, om 'n amalgaam te vorm
- Hexane in die paraffienwas
- Vastestof in vastestof:
- Staal, wat basies 'n oplossing van koolstof-atome in 'n kristalrooster van yster-atome is
- Alloïede soos brons en vele ander
Mengbaarheid
[wysig | wysig bron]Die vermoë van 'n verbinding om te ontbind in 'n ander verbinding word oplosbaarheid genoem. Wanneer 'n vloeistof in staat is om volledig op te los in n ander vloeistof is dié twee vloeistowwe mengbaar. Twee stowwe wat nooit kan meng om 'n oplossing te vorm nie, word onmengbaar genoem.
Oplosbaarheid
[wysig | wysig bron]- Die hoofartikel vir hierdie afdeling is: Oplosbaarheid.
Alle oplossings het 'n positiewe entropie van vermenging. Die interaksies tussen verskillende molekules of ione kan energiek bevoordeel word of nie. As interaksies ongunstig is, sal die vrye energie afneem met toenemende konsentrasie. Op 'n sekere punt sal die energie verlies meer wees as die entropie, so oplossing is dan versadig. Die punt waarby 'n oplossing versadig word kan aansienlik verander met verskillende omgewingsfaktore soos temperatuur, druk, en besoedeling. Hoe hoër 'n vastestof of vloeistof se temperatuur hoe meer stof sal daarin oplos, terwyl meeste gasse as oplosmiddel se oplosbaarheid verminder met verhoogde temperatuur. Hierdie gedrag is die gevolg van 'n eksotermiese entalpie van die oplossing. Die oplosbaarheid van vloeistof in vloeistof is oor die algemeen minder vatbaar vir temperatuur verandering as gas of vastestof in vloeistof.
Eienskappe
[wysig | wysig bron]Die fisiese eienskappe van verbindings soos die smeltpunt en kookpunt verander wanneer ander verbindings daarby gevoeg word.
Die eienskappe van ideale oplossings kan bereken word deur die lineêre kombinasie van die eienskappe van die oplossding se komponente. As beide opgeloste stof en oplosmiddel bestaan in gelyke hoeveelhede (soos bv 'n 50% etanol, 50% water oplossing), word die konsepte van "opgeloste stof" en "oplosmiddel" minder relevant, maar die stof wat meer dikwels gebruik word as 'n oplosmiddel is normaalweg aangewys as die oplosmiddel (in hierdie voorbeeld, water).
Vloeistof oplossings
[wysig | wysig bron]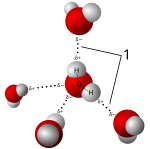
In beginsel kan alle tipes vloeistowwe dien as oplosmiddel: vloeibare edelgasse, gesmelte metale, gesmelte soute, gesmelte kovalente netwerke en molekulêre vloeistowwe. In die praktyk van chemie en biochemie, is die meeste oplosmiddels molekulêre vloeistowwe. Dié vloeistowwe kan geklassifiseer word as polêr en nie-polêr, na gelang van die beskikking oor 'n permanente molekulêre dipool. Nog 'n onderskeid is of die molukule in staat is om waterstof bindings te onderhou of nie. Water, die mees gebruikte oplosmiddel, is beide polêre en kan waterstofbindings onderhou.
Soute los op in polêre oplosmiddels, en vorm positiewe en negatiewe ione wat na die positiewe en negatiewe punte van die oplosmiddel molekules, onderskeidelik aangetrek is. Sulke oplossings staan as elektroliete bekend.
Vir nie-ioniese opgeloste stowwe, is die algemene reël: soort los in soort op
Polêre opgeloste stowwe los op in polêre oplosmiddels, en vorm polêre bindings of waterstofbindings. 'n Voorbeeld hiervan is alkoholiese drank wat waterige oplossings is van etanol. Aan die ander kant, los nie-polêre stowwe beter op in nie-polêre oplosmiddels. Voorbeelde hiervan is verskeie koolwaterstowwe soos olie en ghries wat maklik meng met mekaar, terwyl dit onmengbaar is met water.


