Diffusie
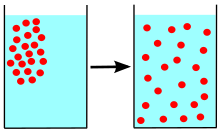
Diffusie is 'n tydafhanklike proses, wat die willekeurige beweging van gegewe entiteite uitmaak, en veroorsaak dat die statistiese verspreiding van hierdie entiteite in 'n gegewe ruimte versprei. Die konsep van diffusie skakel aan die opvatting van massaoordrag, gedryf deur 'n konsentrasiegradiënt; maar diffusie kan ook plaasvind wanneer daar geen konsentrasiegradiënt bestaan nie – dit beteken die afwesigheid van 'n netto deeltjievloed.
Die begrip betreffende diffusie het ontstaan uit die fisiese wetenskappe. Paradigmatiese voorbeelde hiervan is hitte diffusie, molekulêre diffusie, en Brown se beweging. Die wiskundige beskrywing vir hierdie verskynsel is ontwikkel deur Joseph Fourier in 1822, Adolf Fick in 1855 en Albert Einstein in 1905.
Louis Bachelier, wie in die 1900’s 'n willekeurige stap model gebruik het om prysskommelinge in finansiële markte te beskryf, het baanbrekerswerk in toepassings buite die fisika veld gedoen. Op 'n mindere kwantitatiewe mate is die konsep van diffusie in die sosiale wetenskappe aangespoor vir die beskrywing van idees, soos die diffusie van innovasie, leksikale diffusie, en trans-kulturele diffusie.
Diffusie in fisika
[wysig | wysig bron]In molekulêre diffusie is die bewegende entiteite klein deeltjies, oftewel molekules. Dit beweeg willekeurig omdat die deeltjies dikwels bots. Diffusie is hierdie termiese beweging van alle molekules – vloeistof en gas – by temperature bo absolute nulpunt. Die diffusie tempo is net 'n funksie van temperatuur, en word nie deur konsentrasie beïnvloed nie. Brown se beweging word waargeneem met molekules (selfs deeltjies) wat so groot is dat die molekules nie deur hul eie termiese energie gedryf word nie, maar deur botsings van die oplosmiddel se deeltjies.
Brown se beweging is waarneembaar onder 'n mikroskoop, terwyl die klein-molekule diffusie net ondersoek kan word onder noukeurige, beheerde eksperimentele toestande. Onder normale omstandighede is molekulêre diffusie net van belang vanaf 'n nanometer skaal tot 'n millimeter. Met groter lengteskale word transport in vloeistowwe en gasse normaalweg deur ander transport verskynsels veroorsaak, naamlik konveksie.
Hierteenoor is warmtegeleiding (of konduksie) deur soliede mediums 'n alledaagse verskynsel. Dit verduidelik waarom diffusie van hitte wiskundig verduidelik was voor die diffusie van massa.
Ander soorte diffusie
[wysig | wysig bron]- Atomiese diffusie, soos in vastestowwe.
- Dwarrel diffusie, in growwe-grein beskrywings van turbulente vloei.
- Effusie van 'n gas deur klein gaatjies.
- Elektroniese diffusie, wat 'n elektriese stroom veroorsaak, genaamd diffusie stroom.
- Gefasiliteerde diffusie, teenwoordig in sommige organismes.
- Gasdiffusie, wat gebruik word vir isotoop skeiding.
- Die hittevergelyking, diffusie van termiese energie.
- Itō diffusie, wiskunde van Brown se beweging, 'n volgehoue stogastiese proses.
- Knudsen diffusie van gas in lang porieë met herhalende walbotsings.
- Momentum diffusie, byvoorbeeld die diffusie van 'n hidrodinamiese snelheidsveld.
- Osmose is die diffusie van water deur 'n selmembraan.
- Foton diffusie
- Omkeerbare diffusie, teen die konsentrasiegradiënt, in faseskeidings.
- Rotasie diffusie, lukrake heroriëntering van molekules.
- Oppervlakdiffusie, diffusie van adpartikels op 'n oppervlakte.
Eksperimente om diffusie te demonstreer
[wysig | wysig bron]Indien 'n klein hoeveelheid gekleurde oplossing ink, kaliumpermanganaat- of kopersulfaatoplossing baie versigtig (byvoorbeeld met 'n pipet of ʼn spuit) in 'n glas water geplaas word, sal die gekleurde oplossing aanvanklik maklik van die water onderskei kan word.
Mettertyd begin die skeidslyn tussen die twee oplossings vervaag, totdat die hele glas se inhoud gelykmatig gekleur is. Die snelheid waarmee die vermenging plaasvind, hang af van die aard van die stowwe en van die mengsel se temperatuur. Oor die algemeen sal die inhoud eers oor 'n paar dae homogeen wees, dit wil sê oral dieselfde samestelling hê. Hoewel die verspreidingsprosesse versnel kan word deur strominge in die vloeistof te veroorsaak, byvoorbeeld deur dit te roer of te skud, moet daarop gelet word dat die proses ook spontaan plaasvind.
Die spontane vermengingsproses word diffusie genoem en daar kan ook gesê word dat die gekleurde stowwe in die water gediffundeer het. Die woord diffusie is afgelei van die Latynse woord diffundere wat "om uit te sprei" beteken.
Molekulêre basis
[wysig | wysig bron]Die beginsels van diffusie kan verduidelik word aan die hand van die kinetiese gasteorie. Om die teorie te kan gebruik, word uitgegaan van die aanname dat alle stowwe opgebou is uit klein deeltjies, molekules, wat in ruimte vinnig heen en weer beweeg. Die molekulêre of temperatuurbeweging word hewiger namate die temperatuur toeneem (daar meer energie bykom). 'n Molekule beweeg min of meer ongestoord voort, totdat dit toevallig teen ʼn ander molekule bots en albei so van koers gedwing word.
Dan beweeg hulle in die nuwe rigting totdat hulle weer teen ander molekules bots. Die gedurige botsings en rigtingveranderings is heeltemal ewekansig en die koersveranderings sal molekules deur 'n oplossing verplaas. Die botsings kan onder ʼn mikroskoop waargeneem word as ʼn reeks rukkerige bewegings wat molekules uitvoer en dit word Brown se beweging genoem. Brown se beweging vind in gasse en vloeistowwe plaas. Diffusie vind gewoonlik plaas wanneer daar 'n konsentrasieverskil in 'n oplossing is.
Dit kan egter in ʼn heeltemal homogene oplossing plaasvind, maar die effek sal nie sigbaar wees nie omdat die verplasing van 'n molekule uit een deel van 'n oplossing sat vergoed word deur die aankoms van 'n ander molekule vanaf ander dele. Indien daar egter 'n konsentrasieverskil in die oplossing is, dit wil sê as daar meer van 'n stof in een deet van 'n oplossing as in 'n ander is, sal diffusie so plaasvind dat dit die konsentrasieverskil ophef. 'n Voorbeeld hiervan is wanneer 'n druppel eter in 'n kamer gemors word; die etermolekules sal so versprei dat dit in die hele kamer geruik sal word.
Die molekules het dus van 'n deel waar daar baie was (hoë konsentrasie), versprei na die deel waar daar min was (lae konsentrasie), totdat daar oral ewe veel is (konsentrasieverskil opgehef). Die proses vind plaas omdat daar in die hoë konsentrasiegebied meer botsings per sekonde plaasvind as in die laekonsentrasiegebied, want daar is meer molekules in die hoë konsentrasie, wat die waarskynlikheid van botsings verhoog, In die lae konsentrasiegebied sal minder botsings plaasvind en daarom sal daar minder deeltjies na die hoë konsentrasiegebied terugkeer, wat mee bring dat die totale molekulêre beweging in die rigting van die lae konsentrasiegebied is.
Die beweging sal voortduur totdat albei gebiede ewe veel molekules het (geen konsentrasieverkil meer nie; of 'n konsentrasie-ewewig is daargestel). Diffusie kan nou gedefinieer word as die beweging van materie van 'n hoë na 'n lae konsentrasie, totdat die konsentrasieverskil opgehef is.
Soorte diffusie
[wysig | wysig bron]'n Aantal soorte diffusie kan onderskei word na gelang van die deelnemende stowwe se aggregasietoestand:
- Vloeistofdiffusie, waarby twee vloeistowwe betrokke is (soos water en alkohol); hieronder tel ook ʼn oplossing van 'n vaste stof (byvoorbeeld suiker) in 'n vloeistof (byvoorbeeld water)
- Gasdiffusie, waarby twee gasse betrokke is, soos met die verspreiding van 'n parfuumreuk in die lug,
- Vastestofdiffusie tussen twee vaste stowwe, soos die langsame vermenging van pigmente (kleurstofdeeltjies) in ou skilderye.
- Diffusie van 'n gas in 'n vloeistof, soos die vermenging van suurstof met water.
- Diffusie van 'n vloeistof in 'n vaste stof, soos wanneer 'n olievlek op papier versprei.
- Diffusie van 'n gas in 'n vaste stof, 'n verskynsel wat moeilik waargeneem kan word, maar tog gebeur, soos wanneer waterstofgas deur die dun metaalwande van houers lek.
Diffusie verloop makliker indien die deelnemende molekules meer beweegruimte het, dit wil sê groter afstande tussen botsings kan aflê. Diffusie sal die vinnigste in gasse geskied omdat die intermolekulêre ruimtes (ruimtes tussen die verskillende molekules) die grootste in gasse is, terwyl vastestofdiffusie die stadigste sal geskied omdat die intermolekulêre ruimtes baie klein is. Daar is egter ander faktore betrokke en origens word diffusie nie net deur die gedrag van individuele molekules bepaal nie.
So byvoorbeeld word die diffusie van sout in water nie beskou as die diffusie van afsonderlike ione nie, maar as die omringende watermolekules se beweging en gedrag saam met die van die soutione, Dit is moeilik om die diffusie in gasse en vloeistowwe presies te meet omdat 'n verskeidenheid stromingsverskynsels die homogeniseringsproses beïnvloed. Die invloed van strome en Brown se beweging kan nie duidelik van mekaar onderskei word nie en dit is in sommige gevalle ook moeilik om die ewewigspunt te bepaal. Dit kan wel in vastestofdiffusie gedoen word, iets wat van tegniese belang is omdat die vervaardiging van byvoorbeeld transistors hiervan afhang.
Vloeistofdiffusie speel ʼn belangrike rol in die verskillende fotografiese prosesse, veral gedurende die ontwikkeling van negatiewe en afdrukke. Die toepassing van sekere diffusie-eienskappe het groot praktiese belang vir die mensdom. Dit berus daarop dat die diffusiesnelheid van die molekules se bewegingsnelheid afhang; die diffusiesnelheid in gasse eweredig is aan die verhouding T/M, waar T die absolute temperatuur en M die molekulêre massa is.
Die formule stel dat stowwe met verskillende molekulêre massas maar met dieselfde eienskappe onder dieselfde temperatuurstoestande in verskillende tempo's sal diffundeer. 'n Belangrike praktiese toepassing hiervan is die gasdiffusieproses, wat veral gebruik word om uraan te verryk (vir kernreaktors of kernbomme), waar die uraan-235- isotoop van die uraan-238-isotoop geskei moet word. Daar word ʼn gasverbinding van die uraan gemaak deur dit met fluoorgas te konjugeer, wat die gas uraanheksafluoried (UF6) vorm.
Die gas met die twee isotope word in 'n houer saamgepers en dan toegelaat om deur ʼn poreuse wand te diffundeer. Weens die verskil in molekulêre massa diffundeer U-235F6 10 043 keer vinniger deur die wand as U-238F6. Die gas wat eerste deur diffundeer, word in 'n ander houer opgevang en dan word die proses 1 000 keer herhaal voordat dit as 'n monster suiwer U-235 beskou kan word. Termiese diffusie kan gebruik word om sommige stowwe te skei.
Dit berus op die beginsel dat ʼn mens ‘n temperatuursgradiënt in ʼn houer veroorsaak, met ander woorde die een deel warmer maak as die ander. Kleiner molekules sal in die warmer gedeeltes versamel en molekules kan so op grond van hulle molekulêre massas geskei word. Seldiffusie word gebruik om chemies identies maar fisies verskillende stowwe, soos isotope te skei. Die stowwe se onderskeie verplasingsnelhede (wat verwant is aan hul onderskeie atoommassas) word as grondslag hiervoor gebruik.
Die dialiseproses word veral in die biologiese en mediese wetenskap gebruik om verskillende ione, molekules of kolloïedes uit ʼn mengsel te skei. Die beginsel van die proses berus daarop dat die mengsel in 'n sak met 'n halfdeurlaatbare membraan geplaas word. Die molekules word dan toegelaat om op grond van hulle groottes en verskillende diffusietempo's deur die membraan te diffundeer. Molekules met hoë molekulêre massas bly in die sak agter en kan daaruit gehaal word wanneer die proses voltooi is. Die beginsel word in veral nierdialisemasjiene toegepas om die ioniese balans in die bloed van pasiënte met nierskade reg te stel.
Termodinamiese beginsels
[wysig | wysig bron]Diffusie is 'n proses wat van 'n aantal termodinamiese beginsels afhanklik is. ʼn Belangrike gebeurtenis gedurende diffusie is dat 'n hoeveelheid energie in warmte omgeskep sal word. Die energie is afkomstig van chemiese bindingsenergie wat deur die bewegende molekules gebruik word om verbindings met die omringende molekules te vorm. Wanneer die molekules beweeg, word die verbindings verbreek, met 'n gevolglike verlies aan energie.
Omdat die nuwe verbindings wat by die molekules se bestemmings gevorm word, minder energie as die oorspronklikes bevat, sal die totale som van energie beteken dat die reaksie energie verloor het. Die energieverskil is waarneembaar as warmte, wat bydra om die entropie van die sisteem te verhoog. Dit beteken dat 'n sisteem gedurende diffusie na groter wanorde neig omdat die molekules meer verspreid is. Die warmte en die toename in entropie sal die moontlikheid van diffusie in 'n sisteem versterk.
Die bindingsenergie tussen molekules kan die moontlikheid van diffusie beïnvloed. Omdat gasse se molekules ver uitmekaar is, is daar nie 'n groot bindingsenergie wat verbreek moet word nie en daarom sal diffusie maklik plaasvind. In vloeistowwe, waar die molekules egter nader aan mekaar is, met ʼn gevolglik hoër bindingsenergie, sal diffusie moeiliker plaasvind. ʼn Temperatuursverhoging sal diffusie egter vergemaklik.
Diffusie in lewende organismes
[wysig | wysig bron]Diffusie is baie belangrik vir die bestaan van lewende organismes. Die koolstofdioksied wat plantselle vir fotosintese nodig het, word deur die selmembrane deur middel van diffusie vervoer. Suurstof, die produk van fotosintese, verlaat die sel op dieselfde manier. Die gaswisselingsprosesse van diere en die mens berus op dieselfde beginsel.
Eensellige diere, soos Amoeba, verkry suurstof uit die omliggende omgewing omdat die intrasellulêre (binne die sel) suurstofkonsentrasie laer is as die buite die sel (ekstrasellulêr). Koolstofdioksied, wat gedurende respirasie ophoop, verlaat die sel omdat die intrasellulêre konsentrasie hoër is as die ekstrasellulêre konsentrasie.
Gaswisseling deur soogdiere en die mens se longwand geskied op dieselfde manier. Die bloed in die, longe het 'n hoër koolstofdioksied-konsentrasie as die lug in die longholte. Die suurstofkonsentrasie in die longholte is hoër as die in die bloed en gevolglik word die gasse uitgeruil. Deur diffusie in die niere word die ioniese balans in die liggaam sout gehou.
Bronnelys
[wysig | wysig bron]- Wêreldspektrum, 1982, ISBN 090840963X, volume 22, bl. 24
Sien ook
[wysig | wysig bron]| Wikimedia Commons bevat media in verband met Diffusie. |
