Distillasie
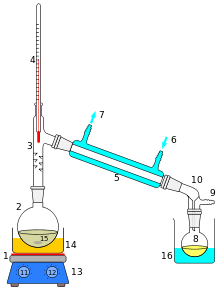
Distillasie is 'n metode vir die skei van mengsels gebaseer op die verskille in hul vlugtigheid in 'n kokende vloeistofmengsel. Distillasie is 'n eenheidswerking of fisiese skeidingsproses en nie 'n chemiese reaksie nie.
Kommersieël het distillasie 'n verskeidenheid gebruike. Dit word gebruik om ru-olie in verskeie brandstoffraksies te skei. Water word gedistilleer om onsuiwerhede soos sout in seewater te verwyder. Lug word gedistilleer om die komponente daarvan te skei vir nywerheidsgebruike, veral noemenswaardig is suurstof, stikstof en argon. Distillasie van gefermenteerde oplossings word al sedert antieke tye gebruik om drank met 'n hoër alkoholinhoud voor te berei (Wyn word byvoorbeeld gedistilleer om brandewyn te verkry).
Geskiedenis
[wysig | wysig bron]
Distillasie in 'n sekere vorme was aan die Babiloniërs in Mesopotamië (die hedendaagse Irak) bekend sedert die 2de millenium v.C.[1] Argeologiese uitgrawings in noordwes Pakistan het bewyse opgelewer dat die distillasie van alkohol sowat 500 v.C. in gebruik was, dit was egter eers tussen 150 tot 350 v.C. in algemene gebruik daar. Distillasie was later bekend aan die Antieke Griekse alchemiste vanaf die eerste eeu n.C.[2][3][4][2] Volgens K. B. Hoffmann is die vroegste aantekening van "destillatio per descensum" in die geskrift van Aetius, 'n Griekse geneeskundige uit die 5de eeu na Christus.[5] Die ontdekking van die vroegste distillasietoestel word aan Hypatia van Alexandrië toegeskryf[6] en die eerste duidelike beskrywing van distillasie is deur Zosimos van Panopolis in die vierde eeu n.C. gedoen.[4] Primitiewe stamme uit Indië het ook distillasie gebruik om 'n drankie genaamd Mahuda te maak. Hierdie antieke metode was nie baie doeltreffend gewees nie.[7]
Die ontdekking van doeltreffende distillasie wat hoë suiwerheid gelewer het word aan Arabiese en Persiese alchemiste toegeskryf in die Midde-Ooste vanaf die agste eeu n.C. Hulle het distillasie prosesse ontwikkel om chemiese stowwe te suiwer soos die suiwering van esters in die maak van parfuum en die vervaardiging van alkohol.[8] Die vroegste distillasieprosesse was eenvoudige enkelstap prosesse met 'n enkele verdamping- en kondensasiestap. Groter volumes is vervaardig deur eenvoudig die proses voortdurend te herhaal. Daar is verslae van Chemici wat soveel as 500 tot 600 distillasies gedoen het om 'n suiwer verbinding te verkry.[9] In die vroeë 19de eeu is die basiese beginsels van die moderne tegnieke ontwikkel soos voorafverhitting en refluks, veral deur die Franse[9] en in 1830 is 'n Britse patent aan Aeneas Coffey uitgereik vir 'n distillasiekolom vir die bereiding van Whiskey [10] wat 'n aaneenlopende proses was en beskou kan word as die voorganger van moderne petrochemiese distillasietorings. In 1877 het Ernest Solvay 'n patent in die V.S.A verkry vir 'n kolom met plate vir die suiwering van ammoniak.[11] Hierdie kolom het die basis gevorm vir die ontwikkeling van distillasiekolomme vir olie en spiritualieë.
Die ontwikkeling van chemiese ingenieurswese as vakgebied aan die einde van die 19de eeu het daartoe gelei dat wetenskaplike eerder a empiriese metodes gebruik is in die ontwerp van distillasietoerusting. Die ontwikkeling van die ru-olienywerheid in die vroeë 20ste eeu het momentum verleen aan die ontwikkeling van metodes soos die McCabe-Thiele metode en die Fenske vergelyking. Die beskikbaarheid van kragtige rekenaars het ook die direkte rekenaarsimulasie van distillasiekolomme moontlik gemaak.
Toepassings van Distillasie
[wysig | wysig bron]Die toepassing van die distillasieproses kan breedweg in vier groepe verdeel word: Laboratoriumskaal distillasie, Nywerheidskaal distillasie, distillasie van kruie, parfume en geneeskundige middels en voedselverwerking.
Die grootste verskil tussen laboratorium- en nywerheidskaal distillasieprosesse is dat distillasie in die laboratorium dikwels stuksgewys uitgevoer word terwyl dié proses op nywerheidskaal aaneenlopend geskied.
'n Geïdealiseerde model van Distillasie
[wysig | wysig bron]Die kookpunt van 'n vloeistof is die temperatuur waar die dampdruk van die vloeistof gelyk is aan die druk in die vloeistof wat dit met ander woorde moontlik maak vir borrels om te vorm. Aangesien die kookpunt afhanklik is van die stelseldruk hang die kookpunt van die druk in daardie stelsel af. 'n Spesiale geval in die verband is die normale kookpunt waar die dampdruk van die vloeistof gelyk is aan die atmosferiese druk.
Daar word dikwels verkeerdelik geglo dat elke komponent in 'n gegewe mengsel by sy eie kookpunt sal kook en dat die dampe van elke komponent in suiwer vorm vrygestel word. Dit vind egter nie plaas nie en selfs in die geïdealiseerde model is dit ook nie hoe vloeistofdampe vorm nie. Raoult se wet en Dalton se wet vorm die basis van die geïdealiseerde model van distillasie waar daar anvaar word dat die dampe wat vrygestel word 'n ewewig bereik.
Raoult se wet maak die aanname dat 'n komponent se bydrae tot die totale dampdruk van die mengsel eweredig is aan die persentasie van daardie komponent in die vloeistofmengsel en die suiwerdampdruk van daardie komponent of meer direk gestel: die parsiële druk is gelyk aan die molfraksie vermenigvuldig met die dampdruk van die komponent in suiwer vorm. Die model geld slegs as daar geen interaksie tussen die komponente is wat kan veroorsaak dat een komponent 'n ander se dampdruk beïnvloed of die vlugtigheid van 'n komponent afhang van sy persentasie in 'n mengsel.
Dalton se wet bepaal dat die totale dampdruk die som van die dampdrukke van elke indiwiduele komponent in die mengsel is. As 'n multikomponent mengsel verhit word sal die dampdruk van elke komponent styg en daarom sal die totale dampdruk ook styg. As die totale dampdruk die omgewingsdruk bereik sal die vloeistof kook en sal die vloeistof na gas omgeskakel word. 'n Mengsel met 'n gegewe samestelling sal by slegs een temperatuur begin kook by 'n gegewe druk as die komponente volledig inmekaar oplosbaar is.
Die implikasie daarvan dat 'n mengsel by 'n enkele temperatuur begin kook is dat ligter komponente nie eerste in suiwer vorm afkook nie. By die kookpunt sal al die vlugtige komponente kook maar vir elke komponent sal sy konsentrasie in die damp dieselfde wees as sy persentasie bydrae tot die totale dampdruk. Ligter komponente het 'n hoër parsiële druk en sal daarom in 'n hoër konsentrasie in die damp voorkom, dit is egter belangrik om kennis te neem dat swaarder komponente ook 'n (kleiner) parsiële druk het en daarom ook in die damp sal voorkom al sal die konsentrasie daarvan in die damp minder wees. Dit is belangrik om daarop te let dat 'n mengsel daarom nie soos 'n suiwer vloeistof by een enkele temperatuur sal kook nie maar dat die temperatuur waarteen die mengsel kook sal styg namate die meer vlugtige stowwe se konsentrasie in die vloeistof afneem.
Enkelstap distillasie en fraksionering suiwer stowwe deur die samestelling van die mengsel op hierdie wyse te verander. Met enkelstap distillasie sal die vloeistof verdamp en sal die konsentrasie van die produk gelykstaande wees aan die ewewigskonsentrasie van die damp. In fraksionering word vele ewewigstappe in 'n distillasiekolom bereik en die vloeistowwe hoër in die kolom meer ligte komponente bevat en teen 'n laer kookpunt kook.
Die geïdealiseerde model is akkuraat in die geval van vloeistowwe met soortgelyke chemiese eienskappe soos byvoorbeeld benseen en tolueen. In ander gevalle word sterk afwykings van Raoult- en Dalton se wette waargeneem, veral noemenswaardig is die geval van water en etanol. Hierdie verbindings sal wanneer dit saam verhit word 'n azeotroop vorm, wat 'n samestelling is waarvan die kookpunt hoër of laer is as die kookpunt van die afsonderlike suiwer komponente. In so 'n mengsel kan komponente nie verder deur distillasie gesuiwer word nie aangesien die dampsamestelling dieselfde is as dié van die vloeistofmengsel. Alhoewel daar rekenkundige tegnieke bestaan om die gedrag van 'n mengsel van vloeistowwe te voorspel is die beste manier om akkurate vloeistof-damp ewewigsdata te verkry deur meting.
Distillasie in die nywerheid
[wysig | wysig bron]
Grootskaalse nywereidsdistillasie sluit beide enkelstap en aaneenlopende fraksionele, vakuum-, azeotropiese-, ekstraktiewe en stoomdistillasie in. Die algemeenste distillasieproses is fraksionele distillasie by gestadigde toestand in olieraffinaderye, petrochemiese en chemiese aanlegte en aardgas verwerkingsaanlegte.
Distillasie word in die nywerheid[12][13] word tipies in groot, vertikale silindriese staalkolomme uitgevoer wat algemeen as distillasietorings of distillasiekolomme bekend staan met deursneë wat wissel van 65 cm tot soveel as 16 meter en hoogtes wat kan wissel van 6- tot 90 meter. As die proses gebruik word om 'n voermateriaal te skei wat uit 'n groot verskeidenheid komponente bestaan soos in die geval van ru-olie, word uitlate op verskillende hoogtes van die kolom beskikbaar gemaak sodat 'n verskeidenheid fraksies of produkte met verskillende kookpunte of kookpuntreekse onttrek kan word. Die ligste produkte (die met die laagste kookpunte) sal by die bokant van die kolom onttrek word en die swaarste produkte (die met die hoogste kookpunte) sal aan die onderkant van die kolom onttrek word en word die bodemproduk genoem.
Grootskaalse nywerheidstorings gebruik 'n refluks om 'n meer volledige skeiding te bewerkstellig. Die refluks is 'n gedeelte van die oorhoofse vloeistofproduk van 'n distillasietoring wat na die boonste deel van die toring teruggepomp word. Binne die toring veroorsaak die refluks wat met die kolom afvloei dat verkoeling en kondensasie van die stygende dampe bewerkstellig word en daardeur word die doeltreffendheid van die distillasietoring verhoog.
Verwysings
[wysig | wysig bron]- ↑ Martin Levey (1956). "Babylonian Chemistry: A Study of Arabic and Second Millennium B.C. Perfumery", Osiris 12, p. 376-389.
- ↑ 2,0 2,1 Colin Archibald Russell (2000). Chemistry, Society and Environment: A New History of the British Chemical Industry. Royal Society of Chemistry. p. 69. ISBN 0-85404-599-6.
- ↑ Edgar Ashworth Underwood. Science, Medicine, and History: Essays on the Evolution of Scientific Thought and Medical. Oxford University Press. p. 251.
- ↑ 4,0 4,1 Charles Simmonds (1919). Alcohol: With Chapters on Methyl Alcohol, Fusel Oil, and Spirituous Beverages. Macmillan and Co. Ltd. p. 6.
- ↑ Distillation – LoveToKnow 1911
- ↑ Biology, Joan Solomon, Pat O'Brien, Peter Horsfall, Nelson Thornes, bl.41
- ↑ Forbes 1970: 53-54
- ↑ Robert Briffault (1938), The Making of Humanity, bl. 195
- ↑ 9,0 9,1 D. F. Othmer (1982) Distillation – Some Steps in its Development, in W. F. Furter (ed) A Century of Chemical Engineering ISBN 0-306-40895-3
- ↑ A. Coffey Britse Patent nommer 5974, 5 August 1830
- ↑ V.S.A Patent nommer 198699 Improvement in the Ammonia-Soda Manufacture
- ↑ Perry, Robert H. and Green, Don W. (1984). Perry's Chemical Engineers' Handbook (6th uitg.). McGraw-Hill. ISBN 0-07-049479-7.
{{cite book}}: AS1-onderhoud: meer as een naam (link) - ↑ Kister, Henry Z. (1992). Distillation Design (1st uitg.). McGraw-Hill. ISBN 0-07-034909-6.
