Fosfaat: Verskil tussen weergawes
Content deleted Content added
Jcwf (besprekings | bydraes) No edit summary |
Jcwf (besprekings | bydraes) No edit summary |
||
| Lyn 1: | Lyn 1: | ||
{{Ioonkas |
|||
| ⚫ | |||
|beeld1=Phosphat-Ion.svg |
|||
| ⚫ | |||
|term.rad= 2,30 Å <ref name="Roobo">''Thermochemical Radii of Complex Ions'' {{Outeur|Helen K. Roobottom, H. Donald B. Jenkins, Jack Passmore, Leslie Glasser}} Journal of Chemical Education 76(11) 1999, bls. 1570</ref> }} |
|||
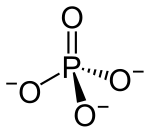
'''Fosfaat''' (PO<sub>4</sub><sup>3-</sup>) is die vorm waarin [[fosfor]] die meeste in verbindings voorkom. Fosfate is suurreste van [[fosforsuur]] (H<sub>3</sub>PO<sub>4</sub>). Die meeste fosfate los nie maklik in water op nie, en kan daarom maklik uit 'n oplossing met 'n [[neerslagreaksie]] verwyder word. |
'''Fosfaat''' (PO<sub>4</sub><sup>3-</sup>) is die vorm waarin [[fosfor]] die meeste in verbindings voorkom. Fosfate is suurreste van [[fosforsuur]] (H<sub>3</sub>PO<sub>4</sub>). Die meeste fosfate los nie maklik in water op nie, en kan daarom maklik uit 'n oplossing met 'n [[neerslagreaksie]] verwyder word. |
||
| Lyn 5: | Lyn 8: | ||
== Sien ook == |
== Sien ook == |
||
*[[Lys van anione]] |
*[[Lys van anione]] |
||
==Verwysings== |
|||
{{Verwysings}} |
|||
{{Saadjie}} |
{{Saadjie}} |
||
Wysiging soos op 00:16, 26 Maart 2017
|
Algemeen | |
|---|---|
| Naam | Fosfaat |
 |
|
| Termochemiese radius | 2,30 Å [1] |
| Lys van anione | |
Fosfaat (PO43-) is die vorm waarin fosfor die meeste in verbindings voorkom. Fosfate is suurreste van fosforsuur (H3PO4). Die meeste fosfate los nie maklik in water op nie, en kan daarom maklik uit 'n oplossing met 'n neerslagreaksie verwyder word.
Sien ook
Verwysings
- ↑ Thermochemical Radii of Complex Ions Helen K. Roobottom, H. Donald B. Jenkins, Jack Passmore, Leslie Glasser Journal of Chemical Education 76(11) 1999, bls. 1570
