Elektromagnetiese spektrum
'n Elektromagnetiese spektrum is die reeks frekwensies (die spektrum) van elektromagnetiese straling en hul onderskeie golflengtes en foton-energieë.
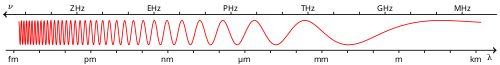
Die frekwensies waarteen elektromagnetiese golwe voortplant vorm 'n aaneenlopende spektrum. Hierdie spektrum wissel vanaf lae frekwensies, soos in die geval van laefrekwensie (LF) wisselstroom, tot by kosmiese straling. Daar is in beginsel geen verskillende tipes elektromagnetiese radiasie nie en die verdeling daarvan in verskillende frekwensie bande is as gevolg van geskiedkundige faktore, fisiologiese faktore (bv. sigbare lig), opwekkingsmetodes en spesifieke eienskappe van die straling wat bestudeer is.
Die elektromagnetiese spektrum word hieronder aangegee:
| Gebied | Frekwensies | Golflengte |
|---|---|---|
| Radiogolwe | 30 x - 3 x Hz | km mm |
| Infrarooi | 3 x - 4.1 x Hz | mm nm |
| Sigbare spektrum | 4.1 x - 7.5 x Hz | nm nm |
| Ultraviolet | 7.5 x - Hz | nm nm |
| X-strale | > Hz | < nm |
| Gammastrale | > Hz | < pm |
Radiofrekwensies (RF) word konvensioneel verdeel in bande van tientalle van frekwensie of golflengte.
Tipe van straling
[wysig | wysig bron]Sigbare straling (lig)
[wysig | wysig bron]
Saamgestelde ofte wel wit lig kan op verskillende maniere (byvoorbeeld deur middel van 'n prisma, spektroskoop of reëndruppels) in 'n spektrum van kleure, naamlik violet, indigo, blou, groen, geel, oranje en rooi, opgebreek word.
Dit blyk dat hierdie spektrale kleure elk 'n unieke frekwensie of golflengte het waaraan dit herken kan word. Baie ligbronne vertoon nie 'n deurlopende spektrum waarin al die golflengtes aanwesig is nie maar 'n onderbroke spektrum of 'n spektrum wat slegs uit 'n aantal smal lyne bestaan. Sulke spektra kan heelwat inligting verskaf oor die bou van die deeltjies waardeur lig uitgestraal word. Spektrumontleding behels atoomspektroskopie of molekuulspektroskopie; laasgenoemde staan meestal net as spektroskopie bekend.
Algemeen
[wysig | wysig bron]Lig word in die vorm van elektromagnetiese golwe voortgeplant. Elke liggolf (byvoorbeeld groen lig, rooi lig, ensovoorts) het 'n spesifieke golflengte (), en word met 'n sekere frekwensie () voortgeplant. Die golflengte is omgekeerd eweredig aan die frekwensie, dit wil sê c= . v, waarby c die ligsnelheid is.
Sowel die ligsnelheid as die golflengte word beïnvloed deur die medium waardeur 'n liggolf beweeg. Die snelheid van lig in lug is byvoorbeeld 300 000 km/s, in water 225 000 km/s en in glas 200 000 km/s. Die frekwensie bly egter konstant en dit is gebruiklik om liggolwe uit te ken aan die frekwensies daarvan. Die frekwensie is ook 'n maatstaf vir die energie-inhoud van 'n golf. By sigbare lig is die liggolf-frekwensies baie hoog (sowat 5 X 1014 Hz).
Golflengtes word dikwels in die atomiese lengte-eenheid (1= 10- 10 m) of in nm (nanometer of 10-9 m) uitgedruk. Die golflengtes van die verskillende kleure lig lê tussen 400 en 800 nm. Lig waarin slegs golwe met dieselfde frekwensie (en golflengte) voorkom, staan bekend as monochromatiese (eenkleurige) lig. Sulke lig gee die oog 'n enkelvoudige kleurindruk - blou lig se golflengte is 450 nm, dié van geel ongeveer 570 nm, dié van rooi ongeveer 650 nm, ensovoorts.
Saamgestelde of wit lig, wat byvoorbeeld van 'n gloeilamp of die son afkomstig is, bestaan uit 'n kombinasie van al die golflengtes. Die spektrum van wit lig kan op verskeie maniere verkry word. Die algemeenste metode is breking met behulp van 'n prisma of 'n diffraksierooster. Die lugbundel wat op hierdie manier verkry word, het die kenmerkende kleurpatroon van die spektrum, naamlik violet, indigo, blou, groen, geel, oranje en rooi. Dieselfde spektrum word waargeneem in die reënboog, wat gevorm word deur die weerkaatsing en die breking van lig deur reëndruppels.
Vir die ondersoek van 'n spektrum word 'n spektroskoop gebruik, en wanneer die sterkte (intensiteit) van die lig terselfdertyd gemeet word, word dit 'n spektrometer genoem. 'n Spektrograaf is 'n samestelling van 'n spektrometer en 'n registreertoestel met 'n pen, waarmee die verskillende ligintensiteite by die verskillende golflengtes aangeteken word. Die golflengtes van die kleure van die spektrum kan bepaal word uit die hoeke waaronder dit gebreek word.
In die geval van monochromatiese lig kan die golflengte op dieselfde manier bepaal word. Lig waarvan al die golflengtes binne die sigbare spektrum val, het 'n deurlopende spektrum. Sommige ligbronne soos natrium en kwiklampe het egter nie 'n deurlopende spektrum nie, maar 'n onderbroke spektrum wat byvoorbeeld uit 'n aantal smal lyne kan bestaan. Die golflengte en die intensiteit van die lyne word egter soos gewoonlik bepaal. Dit word die spektrale samestelling of die spektrum van die bron genoem.
Uit hierdie spektrum kan inligting bekom word oor die bou en samestelling van die deeltjies (atome, molekules) waardeur die lig uitgestuur word. Die teorie oor die bou van die atoom is ook gegrond op onder meer spektroskopiese ondersoeke. 'n Emissiespektrum ontstaan wanneer 'n stof lig uitstraal. Dit geskied byvoorbeeld indien die stof sterk verhit word. Vaste stowwe en vloeistowwe het gewoonlik deurlopende spektra en gasse onderbroke spektra.
By 'n onderbroke spektrum word 'n lynspektrum met 'n beperkte aantal spektrale lyne verkry, en dikwels ook 'n bandspektrum van een of meer ligbande met enkele lyne tussenin. By die bandspektrum, wat veral deur molekules uitgesend word, blyk dit by noukeurige ondersoek dat die bande uit 'n groot aantal dig teen mekaar liggende lyne bestaan. 'n Groot aantal stowwe kan ook lig opneem wanneer dit op die stof val, waardeur die intensiteit van die lig dan afneem (stralingsabsorpsie).
Hierdie absorpsie word beïnvloed deur die golflengte van die lig. As daar 'n absorberende stof tussen 'n ligbron met 'n deurlopende spektrum en 'n spektrometer is, sal hierdie stof dieselfde kleure absorbeer as wat dit by emissie sou uitsend. So is die Fraunhoferlyne in die sonspektrum byvoorbeeld absorpsielyne wat ontstaan het deurdat gasse sommige ligkomponente geabsorbeer het. Hierdie lyne is in 1814 deur Joseph van Fraunhofer (1787-1826) ontdek.
Die lyne wat in die emissiespektrum van hierdie stof afgebeeld sou wees, het dus uit die absorbsiespektrum verdwyn. Die sigbare spektrum bevat golwe met golflengtes van tussen 400 en 800 nm. Die spektrum met laer frekwensies as die van die rooi lig word die infrarooispektrum genoem en die spektrum met hoër frekwensies as dié van die violetlig die ultravioletspektrum. Onder die infrarooi gebied lê die radio- en radargolwe, en bokant die ultravioletgebied die röntgen- en gammastraling.
Atoomspektroskopie
[wysig | wysig bron]In die spektraalanalise word die kenmerkende lynspektrum van atome en molekules bestudeer. Die molekuulspektroskopie, wat meestal kortweg spektroskopie genoem word, is vir chemici 'n baie nuttige hulpmiddel by die studie van die bou van molekules.
Die atoomspektroskopie word teenswoordig veral gebruik om die samestelling van die verskillende chemiese verbindings te ondersoek. Die aanwesigheid (en die hoeveelheid) van sekere elemente in 'n onbekende monster kan bevestig word deur die spektrum van die monster met bekende atoomspektra te vergelyk. Die verklaring waarom 'n atoom kenmerkende spektraallyne uitstraal, is egter nie eenvoudig nie. Die beskrywing van lig as 'n golfverskynsel is dan ook ontoereikend hiervoor.
Dit blyk dat daar by die wisselwerking tussen lig en materie verskynsels plaasvind wat slegs verklaar kan word as lig as 'n stroom energiepakkies beskou word. Hierdie pakkies, wat fotone of kwanta genoem word, word in die rigting van die straling voortgeplant.
Vlam- en boogspektroskopie
[wysig | wysig bron]Die spektra van vloeistowwe en vaste stowwe is weens talle bykomende emissies baie ingewikkelder om te ontleed as die van gasse. Om 'n atoomspektrum te verkry, moet die monster eers in 'n damptoestand gebring word, want in dampvorm is die atome nie meer so sterk gebonde nie. In vlamspektroskopie dien die vlam as energiebron om 'n stof te laat verdamp. Die monster wat ontleed moet word, word opgelos en as vloeistofnewel in 'n vlam verhit.
'n Vlamspektrum vertoon egter weinig lyne. Die temperatuur van die vlam is nie hoog genoeg om baie elektrone van baan te laat verander en emissie te verkry nie. Die reproduseerbaarheid van die spektra is egter goed omdat die toevoer van die brandgasse noukeurig gereël kan word. Hoër temperature word verkry deur middel van boogontlading. Boogontlading vind plaas tussen twee elektrodes wat deel vorm van 'n elektriese stroomkring.
Die boog ontstaan as gevolg van 'n hoë elektriese spanning wat oor die elektrodes aangelê word. Die monster wat ontleed moet word, word in 'n verpoeierde vorm in 'n holte in een van die elektrodes geplaas. Wanneer die boogontlading plaasvind, sal die monster smelt, verdamp en vervolgens 'n emissie lewer (boogspektrum).
Lees ook
[wysig | wysig bron]Bronne
[wysig | wysig bron]- J. Thuery (geredigeer deur E. H. Grant, King's College London), "Microwaves: Industrial, Scientific and Medical Applications," Artech House, 1992, pp.4 - 5.
- KENNIS, 1980, vol 5, bl. 876-877, ISBN 0 7981 0827 4
- Wêreldspektrum, 1982, ISBN 0908409672, volume 26, bl. 84 - 86