Distikstoftrioksied
|
Algemeen | |
|---|---|
| Naam | Distikstoftrioksied |
| Ander name | stikstof(III)oksied |
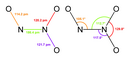 |
 |
| Chemiese formule | N2O3 |
| Molêre massa | 76,0116 g/mol |
| CAS-nommer | 10544-73-7[1] |
| Voorkoms | blou vloeistof (onder druk)[2] |
| Reuk | onaangenaam |
| Fasegedrag | |
| Smeltpunt | -100,1 °C |
| Kookpunt | +3,5 °C |
| Digtheid | 1,447 g/cm3 (l); 1,694 (s) |
| Oplosbaarheid | Reageer met water |
| Brekingsindeks | 1,531 °C |
| ΔfHɵ (s) | 21,628 kcal/mol @0 K |
| ΔfHɵ (l) | 12.03 kcal/mol @300 K[3] |
|
Suur-basis eienskappe | |
| pKa | |
|
Veiligheid | |
| Flitspunt | |
|
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
Distokstoftrioksied is 'n chemiese verbinding van stikstof en suurstof met formule N2O3. Dit is die anhidraat van nitroësuur.
Die eerste chemikus wat dit vervaardig het, is Gay-Lussac in 1816. Dit is 'n giftige en reaktiewe gas wat onder ligte druk 'n vloeistof vorm. By 'n temperatuur laer as -100,1 °C is dit 'n ligteblou vastestof wat smelt tot 'n diepblou vloeistof. By 'n temperatuur van omtrent 0 °C kry dit 'n groen kleur omrede daar in hierdie vloeistof 'n ontbindingsewewig plaasvind:
en
Die tetroksied is gelerig en saam met die blou kleur gee dit groen.[3]
Die stof reageer met water en vorm nitroësuur. Hierdie reaksie is in ewewig:
Die ewewigskonstante
N2O3 kan uit NO en N2O4 by -20 °C vervaardig word. 'n Ander metode is om 1:1 verdunde salpetersuur op arseen(III)oksied te drup teen 70 °C:
Distikstoftrioksied kan gebruik word om nitrosielsoute van sterk sure te vervaardig, soos NO+HSO−4, NO+HSeO−4 of NO+BF−4
Verwysings
[wysig | wysig bron]- ↑ "Guidechem" (in Engels). Geargiveer vanaf die oorspronklike op 23 September 2014.
- ↑ "Cameo chemicals" (in Engels). Geargiveer vanaf die oorspronklike op 3 Augustus 2017.
- ↑ 3,0 3,1 The Chemistry of Nitrogen: Pergamon Texts in Inorganic Chemistry K. Jones Elsevier, 2016, ISBN 1-4831-3962-X, ISBN 978-1-4831-3962-3




![{\displaystyle K={\frac {[N_{2}O_{3}]}{[HNO_{2}]^{2}}}\approx 3,0x10^{-3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/07c9c930ff23ddb306992a0b7472ed4b1afe6018)
