Koördinasiegetal
In chemie, kristallografie en materiaalwetenskap is die koördinasiegetal, ook bekend as ligansie, van 'n sentrale atoom in 'n molekule of kristal die aantal atome, molekules of ione wat daaraan gebind is. Die nabure van die sentrale atoom word ligande genoem.
Die konsep is in 1893 deur die Switserse chemikus Alfred Werner gedefinieer
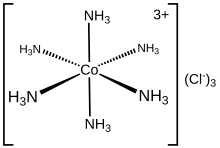
Vir molekules en multi-atomiese ione word die koördinasiegetal van 'n atoom bepaal deur eenvoudig die ander atome waaraan dit gebind is (deur enkel- of meervoudige bindings) te tel.[1] Byvoorbeeld, [Cr(NH3)2Cl2Br2]- het Cr3+ as sentrale katioon, wat 'n koördinasiegetal van 6 het en beskryf word as heksakoördinaat.
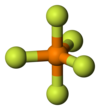
Die algemene koördinasiegetalle is 4 vir 'n tetraëdriese omringing, 6 vir oktaëdriese omringing en 8 vir 'n heksaëdriese omringing.
Eenvoudige voorbeelde
[wysig | wysig bron]Vir chemiese verbindings met 'n gereelde verpakkingsstruktuur soos natriumchloried en sesiumchloried, gee 'n telling van die naaste bure 'n goeie beeld van die omgewing van die ione. In natriumchloried het elke natriumioon 6 chloriedione as die naaste bure (om 276 pm) op die hoeke van 'n oktaëder en elke chloriedioon het 6 natriumione (ook om 276 pm) aan die hoeke van 'n oktaëder. In sesiumchloried het elke sesiumioon 8 chloriedione (om 356 pm) op die hoeke van 'n kubus en elke chloriedioon het agt sesiumione (ook om 356 pm) op die hoeke van 'n kubus.
Die twee mees algemene allotrope van koolstof het verskillende koördinasiegetalle. In diamant is elke koolstofatoom in die middel van 'n gewone tetraëder gevorm deur vier ander koolstofatome, die koördinasiegetal is vier, net soos metaan. Grafiet is gemaak van tweedimensionele lae waarin elke koolstof kovalent aan drie ander koolstowwe gebind is; atome in ander lae is verder weg en is nie die naaste bure nie, wat 'n koördinasiegetal van 3 gee.[2]
Die d-blok oorgangsmetale vorm komplekse met koördinasiegetalle van 2 tot 9, waarvan 6 die algemeenste is. Byvoorbeeld, ReVIII in [ReH9]2- het koördinasie nommer 9.
Die f-blokelemente (Lantaniede en Aktiniede) kan hoër koördinasiegetalle akkommodeer as gevolg van hul groter ioniese radiusse en die beskikbaarheid van meer orbitale vir binding. Koördinasiegetalle van 8 tot 12 word gewoonlik waargeneem vir f-blokelemente. Byvoorbeeld, CeVI in [Ce(NO3)6]2− en ThIV in [Th(NO3)6]2− het beide koördinasiegetalle van 12.
Komplikasies
[wysig | wysig bron]
In sommige verbindings is die metaal-ligandbindings nie almal dieselfde lengte nie. In sommige gevalle word slegs die naaste bure getel, en in ander word ook die bure wat verder verwyder is, getel.
Sommige metale het onreëlmatige strukture. Gereelde seshoekige verpakking dui daarop dat sink 12 naaste bure het, maar sink het 'n verwronge struktuur van nabye verpakking, met 6 bure in dieselfde vlak en 3 bo en 3 onder teen 'n groter afstand. Die koördinasiegetal word egter beskou as 12, nie 6 nie. Sink kan ook 'n liggaamsgesentreerde kubieke struktuur hê, wat tot 8 naaste bure lei, en nog 6, ongeveer 15% verder weg. In hierdie geval word die koördinasiegetal as 14 beskou en nie 8 nie.
Baie chemiese verbindings het verwronge strukture, byvoorbeeld NiAs, Fe2O3 en TiO2 en daarom het hulle nie duidelike koördinasiegetalle nie.
Vloeistowwe en ander wanordelike stelsels
[wysig | wysig bron]
Vir stelsels wat onordelik is, kan die koördinasiegetalle bepaal word met behulp van 'n radiale verspreidingsfunksie g(r) (wat beskryf hoe digtheid wissel as 'n funksie van die afstand vanaf 'n verwysingsdeeltjie):[3][4]
waar n1 die eerste koördinasiegetal is, is ro en r1 afstande vanaf die atoom en g(r) is omtrent nul by r=0.
Haptisiteit
[wysig | wysig bron]
In gevalle waar die bindingselektrone gedelokaliseer word, soos in die siklopentadienied-ringe wat aan yster geheg word in ferroseen, word die koördinasiegetal meer dubbelsinnig en word die term "haptisiteit", η, eerder gebruik. In ferroseen is die haptisiteit van elke siklopentadenielligand 5, Fe(η5-C5H5)2. Die bydrae van elke siklopentadieniedligand tot die koördinasiegetal van die sentrale ysteratoom kan 1 wees, aangesien elke siklopentadieniedligand een ligand is, of vyf aangesien die ligand vyf atome bevat wat die bure van die ysteratoom is, of drie aangesien daar drie elektronpare betrokke is by die binding. Normaalweg word die aantal elektronpare gebruik.
Verwysings
[wysig | wysig bron]- ↑ "Coordination number". IUPAC Compendium of Chemical Terminology (in Engels) (2de uitg.). Research Triangle Park, NC: IUPAC. 1997. doi:10.1351/goldbook.c01331. ISBN 0-9678550-9-8.
- ↑ Wells, A.F. (1984). Structural Inorganic Chemistry (in Engels) (5de uitg.). Oxford Science Publications. ISBN 978-0198553700.
- ↑ Waseda, Y. (1980). The Structure of Non-crystalline Materials: Liquids and Amorphous Solids. Advanced Book Program (in Engels). McGraw-Hill International Book Company. ISBN 978-0-07-068426-3. Besoek op 16 Oktober 2020.
- ↑ Vahvaselkä, K. S.; Mangs, J. M. (1988). "X-ray diffraction study of liquid sulfur". Physica Scripta. 38 (5): 737. Bibcode:1988PhyS...38..737V. doi:10.1088/0031-8949/38/5/017.