Metaan
|
Algemeen | |
|---|---|
| Naam | Metaan |
 |
 |
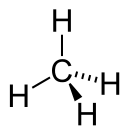
| Chemiese formule | CH4 |
| Molêre massa | 16.04 g/mol |
| CAS-nommer | |
| Fasegedrag | |
| Smeltpunt | -182 °C |
| Kookpunt | -164 °C |
| Digtheid | 0.66 kg/m³ |
| Oplosbaarheid | |
| Henry se konstante | 1,3 x 10-3 [L/mol.atm] 1750 [K][1] |
|
Suur-basis eienskappe | |
| pKa | |
|
Veiligheid | |
| Flitspunt | |
|
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
Metaan of moerasgas is die eenvoudigste vorm van 'n koolwaterstof, en die eerste in die reeks van die alkane. Dit is 'n gas (teen standaard temperatuur en druk) met die chemiese formule van CH4. Egte metaan is reukloos, maar in die praktyk word byprodukte gebruik om dit moontlik te maak om metaangaslekke betyds op te spoor.
Chemie
[wysig | wysig bron]Metaan is 'n belangrike brandstof. As een molekule metaan verbrand word in die teenwoordigheid van suurstof word een molekule CO2 en twee molekules H2O (water) vrygestel: CH4 + 2O2 → CO2 + 2H2O
Behalwe verbranding is metaan nie baie reaktief nie. Dit reageer byvoorbeeld nie met sterk sure of basisse nie. Met 'n halogeen soos chloor is lig nodig om die chloormolekuul in twee radikale chlooratome te breek. Hierdie radikale tas 'n C-H binding aan:
Hierdie radikale tas 'n C-H binding van metaan aan:
- Kon nie verbeeld nie (MathML: Invalid response ("Math extension cannot connect to Restbase.") from server "http://localhost:6011/af.wikipedia.org/v1/":): {\displaystyle Cl\bullet + CH_4 \to HCl + \bullet CH_3}
Die gevormde metielradikaal is baie reaktief en kan byvoorbeeld met 'n chloorradikaal reageer en metielchloried vorm:
Soms kan dit nogtans ook met 'n ander metielradikaal reageer en 'n etaanmolekuul vorm:
Metaan kan ook met swaweltrioksied reageer en metielsulfonsuur vorm:[2]
Groenhuisgas
[wysig | wysig bron]Metaan is een van die gasse wat verantwoordelik is vir aardverwarming, en veroorsaak ongeveer 21 keer meer aardverwarming as koolstofdioksied (CO2) per volume, en dit is die rede waarom dit gewoonlik by groot aanlegte verbrand word eerder as om dit in die atmosfeer vry te stel.
Bronne van metaangas
[wysig | wysig bron]- Vleilande
- Oseane en groot watermassas
- Diere ontlasting
- Natuurlike gas vrygestel tydens die ontginning van olie en steenkool
- Rysboerdery
- Vullishope
- Entiriese fermentasie
- Verbranding van biomassas
Titaan
[wysig | wysig bron]Metaan is 'n belangrike komponent van die atmosfeer van Saturnus se maan Titaan en daar is op die oppervlakte mere wat uit metaan, etaan en stikstof bestaan. Die molfraksie van die gas in die atmosfeer is deur die Huygens gaschromatagraaf-massaspektrometer (GCMS) bepaal. Van 'n 32-146 km hoogte is dit op 'n uniforme 0,014 ± 0,0007 vasgestel. Nader aan die maan setroposfeer neem dit toe tot 0,049±0.00025 op 'n hoogte van 8 km en dit bly so tot by die oppervlak. Teen 'n hoogte van 16-14 km is die meting dalk versteur deur 'n druppeltjie vloeibare (of vaste) metaan wat die GCMS bereik het. Op hierdie hoogte bestaan dalk 'n metaannewel.[3]
Verwysings
[wysig | wysig bron]- ↑ Sander.
- ↑ Speight, James G. (2022). "Chapter 8 Principal products of gas processing and uses" in: Gas Engineering: Vol. 2: Composition and Processing of Gas Streams. Berlin, Boston: De Gruyter. pp. 394–448. doi:10.1515/9783110691054-008.
{{cite book}}: AS1-onderhoud: gebruik authors-parameter (link) - ↑ Titan from Cassini-Huygens Robert Brown, Jean Pierre Lebreton, Hunter Waite Springer Science & Business Media, 2009, ISBN 1-4020-9215-6, ISBN 978-1-4020-9215-2
Eksterne skakels
[wysig | wysig bron] Wikimedia Commons het meer media in die kategorie Metaan.
Wikimedia Commons het meer media in die kategorie Metaan.




