Oksidasietoestand
In Chemie is die Oksidasietoestand 'n aanduiding van die graad van oksidasie van 'n atoom in 'n chemiese verbinding. Die formele oksidasietoestand is die hipotetiese lading wat 'n atoom sou gehad het as al die verbindings tot andersoortige elemente 'n 100% ionies van aard was. Volgens konvensie word oksidasietoestand aangedui met Arabiese syfers en kan dit positief, negatief of nul wees.
Die proses waartydens die oksidasietoestand van 'n atoom toeneem word oksidasie genoem; 'n afname in oksidasietoestand word reduksie genoem. Sulke reaksies behels die oordrag van elektrone, 'n netto toename aan elektrone is 'n reduksie en 'n netto afname is 'n oksidasie.
Die definisie van oksidasietoestand deur IUPAC is as volg:
"Oksidasietoestand :'n Mate van die graad van oksidasie van 'n atoom in 'n stof. Dit word gedefinieer as die denkbeeldige lading wat 'n atoom sou hê as elektrone getel word volgens 'n ooreengekome stel reëls: (1) die oksidasietoestand van 'n vrye element (onverbonde element) is nul; (2) vir 'n eenvoudige (monatomiese) ioon, is die oksidasietoestand gelyk aan die netto lading op die ioon; (3) waterstof het 'n oksidasietoestand van 1 en suurstof het 'n oksidasietoestand van -2 wanneer hulle in die meeste verbindings teenwoordig is. (Uitsonderings hierop is dat waterstof 'n oksidasietoestand van -1 in hidriede van aktiewe metale het, bv. LiH, en suurstof het 'n oksidasietoestand van -1 in peroksiede, bv. H2O2; (4) die algebraïse som van oksidasietoestande van alle atome in 'n neutrale molekuul moet nul wees, terwyl die algebraïse som van oksidasietoestande van die atome waaruit 'n ioon bestaan gelyk moet wees aan die lading van daardie ioon. Byvoorbeeld, die oksidasietoestand van swael in H2S, S8 (elementêre swael), SO2, SO3, en H2SO4 is respektiewelik: -2, 0, +4, +6 en +6. Hoe hoër die oksidasietoestand van 'n gegewe atoom is, hoe groter is sy graad van oksidasie; hoe laer die oksidasietoestand is, hoe groter is die graad van reduksie."
Berekening van Oksidasietoestand
[wysig | wysig bron]Daar is twee maniere waarop die oksidasietoestand van 'n atoom in 'n verbinding bereken word. Die eerste metode word gebruik vir molekule wat 'n Lewisstruktuur het, wat dikwels die geval is by organiese molekule, terwyl die tweede een gebruik word vir eenvoudige verbindings (molekulêr aldan nie) en vereis nie 'n Lewis-struktuur nie.
Daar moet onthou word dat die oksidasietoestand van 'n atoom nie die "ware" lading op daardie atoom verteenwoordig nie: dit is veral waar by hoë oksidasietoestande, waar die ionisasie-energie wat vereis word om 'n positiewe ioon met meer as 'n enkele positiewe lading baie groter is as die energie beskikbaar in chemiese reaksies. Die toekenning van elektrone tussen atome wanneer 'n oksidasietoestand bereken word is suiwer konvensie. Dit bly egter 'n nuttige hulpmiddel om chemiese reaksies te verstaan.
Vanaf 'n Lewis-struktuur
[wysig | wysig bron]Wanneer die Lewis-struktuur van 'n molekule beskikbaar is, kan die oksidasietoestand ondubbelsinnig toegeken word deur die verskil te bereken tussen die aantal valenselektrone wat 'n neutrale atoom van daardie element sou hê en die aantal elektrone wat "behoort" aan sy Lewisstruktuur. Vir berekeningsdoeleindes behoort elektrone in 'n verbinding tussen atome van verskillende elemente aan die mees elektronegatiewe atoom; elektrone in 'n verbinding tussen atome van dieselfde element word gelykop verdeel en elektrone in 'n alleenpaar behoort slegs aan die atoom met die alleenpaar.
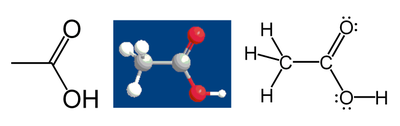
Beskou asynsuur as voorbeeld:
Die koolstofatoom van die metielgroep het 6 valenselektrone van sy verbindings met die waterstofatome omdat die koolstof meer elektronegatief is as waterstof. Verder kry dit 1 elektron by van sy verbinding met die ander koolstof atoom omdat die elektronpaar in die C-C verbinding gelykop verdeel word, wat 'n totaal van 7 elektrone gee. 'n Neutrale koolstofatoom sal 4 valenselektrone hê omdat koolstof in groep 14 van die periokdieke tabel lê. Die verskil, 4 - 7 = -3 is die oksidasietoestand van die koolstofatoom. Dit wil sê as die aanname gemaak word dat al die verbindings 100% ionies is (wat hulle inderwaarheid nie is nie), die koolstof kan beskryf word as C3-.
Deur dieselfde reëls toe te pas op die karboksielsuur se koolstofatoom toe te pas vind ons dat die oksidasietoestand van die atoom +3 is (Dié koolstofatoom kry slegs een elektron vanaf die C-C verbinding; die suurstofatome kry al die ander elektrone omdat suurstof meer elektronegatief is as koolstof). Die suurstofatome het beide 'n oksidasietoestand van -2; hulle kry elk 8 elektrone (4 vanaf die alleenpare en 4 vanaf die verbindings), terwyl 'n neutrale suurstofatoom 6 sou hê. Die waterstofatome het almal 'n oksidasietoestand van +1 omdat hulle almal hulle elektron aan die meer elektronegatiewe atome afstaan waaraan hulle verbind is.
Oksidasietoestande is 'n nuttige hulpmiddel om chemiese vergelykings van redoksreaksies te balanseer, omdat die veranderinge in die geoksideerde atome gebalanseer moet word met die veranderinge in die gereduseerde atome. Die reaksie van asetaldehied met Tollens se reagens om asynsuur te vorm (hierbenede getoon) verander die karbonielgroep se koolstofatoom se oksidasietoestand van +1 tot +3 (oksidasie). Hierdie oksidasie word gebalanseer deur die reduksie van twee ekwivalente silweratome vanaf Ag+ tot Ago.
Sonder 'n Lewisstruktuur
[wysig | wysig bron]Die algebraïse som van oksidasietoestande van alle atome in 'n neutrale molekuul moet nul wees, terwyl die algebraïse som van oksidasietoestande van die atome in 'n ioon gelyk moet wees aan die lading van die ioon. Hierdie reël tesame met die feit dat baie elemente bykans altyd dieselfde oksidasietoestand het, maak dit vir 'n mens moontlik om oksidasietoestande in eenvoudige verbindings te bereken. 'n Paar tipiese reëls wat gebruik word om oksidasietoestande vir eenvoudige verbindings toe te ken is as volg:
- Fluoor het 'n oksidasietoestand van −1 in al sy verbindings aangesien dit die hoogste elektronegatiwiteit het van alle reaktiewe elemente.
- Waterstof het 'n oksidasietoestand van +1 behalwe wanneer dit met meer elektropositiewe elemente soos natrium, aluminium en boor verbind is soos in die geval van NaH, NaBH4 en LiAlH4
- Suurstof het 'n oksidasietoestand van −2 buiten waar dit 'n −1 in peroksiede, −1/2 in superoksiede en 'n +2 in suurstofdifluoried, OF2 en 'n +1 in O2F2 het.
- Alkalimetale het 'n oksidasietoestand van +1 in byna al hul verbindings (uitsondering, sien alkaliede).
- Aardalkalimetale het 'n oksidasietoestand van +2 in byna al hul verbindings.
- Halogene het 'n oksidasietoestand van −1 buiten waar hulle aan suurstof of 'n ander halogeen verbind is.