Ftaalsuur
|
Algemeen | |
|---|---|
| Naam | Ftaalsuur |
| Ander name | 1,2-Benseendioësuur Benseen-1,2-dioësuur orto-Ftaalsuur |
 |
 |
| Chemiese formule | C6H4(CO2H)2 |
| Molêre massa | 166,132 g/mol |
| CAS-nommer | 88-99-3 |
| Voorkoms | wit vastestof |
| Fasegedrag | |
| Smeltpunt | 207 °C |
| Kookpunt | |
| Digtheid | 1,593 g/cm3 |
| Oplosbaarheid | 0,6 g/100mL[1] |
|
Suur-basis eienskappe | |
| pKa | 2.89, 5.51[2] |
|
Veiligheid | |
| Flitspunt | |
|
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |

Ftaalsuur is 'n aromatiese dikarboksielsuur met formule C6H4(CO2H)2. Dit het twee isomere, isoftaalsuur en tereftaalsuur. Alhoewel ftaalsuur van beskeie kommersiële belang is, is die nou verwante afgeleide ftaalsuuranhidried 'n kommoditeitschemikalie wat op groot skaal vervaardig word.[3]
Ftaalsuur is 'n dibasiese suur, wat beteken dat dit twee protone kan skenk. Elke dissosiasie het sy eie dissosiasie-konstante.[2] (Sien infoboks)
Produksie
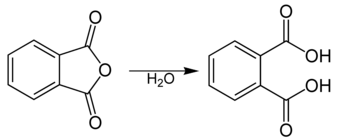
[wysig | wysig bron]Ftaalsuur word vervaardig deur die katalitiese oksidasie van ortoxileen na ftaalsuuranhidried
en 'n daaropvolgende hidrolise van die anhidried.[3]
'n Ander roete gebruik naftaleen wat deur oksidasie met kaliumpermanganaat of kaliumdikromaat ook ftaalsuuranhidried gee, wat dan gehidrogeneer word na ftaalsuur.
Ftaalsuur is die eerste keer deur die Franse chemikus Auguste Laurent in 1836 verkry deur naftaleentetrachloried te oksideer.[4] Hy het geglo dat die resulterende stof 'n naftaleenderivaat is en het dit "naftaalsuur" genoem.[4][5] Nadat die Switserse chemikus Jean Charles Galissard de Marignac die korrekte formule bepaal het, het Laurent die verbinding sy huidige naam gegee.[4][6] Vervaardigingsmetodes in die negentiende eeu het oksidasie van naftaleentetrachloried met salpetersuur, of oksidasie van die koolwaterstof met rokende swaelsuur, met behulp van kwik of kwik(II)sulfaat as katalisator ingesluit.[4]
Verwysings
[wysig | wysig bron]- ↑ "PHTHALIC ACID". hazard.com (in Engels).
- ↑ 2,0 2,1 Brown, H.C. (1955). Baude, E.A.; Nachod, F.C. (reds.). Determination of Organic Structures by Physical Methods (in Engels). New York: Academic Press.
- ↑ 3,0 3,1 Lorz, Peter M.; Towae, Friedrich K.; Enke, Walter; Jäckh, Rudolf; Bhargava, Naresh; Hillesheim, Wolfgang (2007). "Phthalic Acid and Derivatives". Ullmann's Encyclopedia of Industrial Chemistry (in Engels). Weinheim: Wiley-VCH. doi:10.1002/14356007.a20_181.pub2.
- ↑ 4,0 4,1 4,2 4,3 Chisholm, Hugh, red. (1911). "Phthalic Acids". Encyclopædia Britannica (in Engels). Vol. 21 (11de uitg.). Cambridge University Press. pp. 545–546.
- ↑ de Morveau, L.B.G.; Gay-Lussac, J.L.; Arago, F.; Chevreul, M.E.; Berthelot, M.; Mascart, É.É.N.; Haller, A. (1836). "Sur l'acide naphtalique et ses combinaisons". Annales de chimie et de physique. Landmarks II, scientific journals (in Frans). Masson. p. 113.
- ↑ Laurent, Auguste (1841). "Sur de nouvelles combinaisons nitrogénées de la naphtaline et sur les acides phtalique et nitrophtalique". Revue scientifique et industrielle. Revue scientifique et industrielle (in Frans). p. 76.