Karbamaat
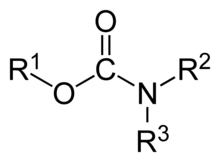
'n Karbamaat is 'n kategorie organiese verbindings wat afkomstig is van karbamiensuur (NH2COOH). Die term bevat organiese verbindings (byvoorbeeld die esteretielkarbamaat), wat verkry word deur een of meer van die waterstofatome deur ander organiese funksionele groepe te vervang; asook soute met die karbamaatanioon H2NCOO− (bv. ammoniumkarbamaat).
Polimere waarvan die eenhede deur karbamaatgroepe met valensie van twee saamgevoeg word –[—NH–(C=O)–O–]– is 'n belangrike familie van plastiek, die poliuretane.
Einskappe
[wysig | wysig bron]In waterige oplossings kom die karbamaatanion stadig in ewewig met die ammonium-katioon (NH+4) en die karbonaat- (CO2−3) of bikarbonaat-anione (HCO−3):[1][2][3]
Kalsiumkarbamaat is oplosbaar in water, terwyl kalsiumkarbonaat (bv. kalksteen) nie is nie. As 'n kalsiumsout by 'n oplossing van ammoniumkarbamaat en ammoniumkarbonaat gevoeg word, sal daar 'n onmiddellike neerslag van kalsiumkarbonaat vorm en dan 'n stadiger neerslag wanneer die karbamaat omskakel.[1]
Sintese
[wysig | wysig bron]Die ammoniumkarbamaat-sout kan gevorm word deur ammoniak met koolstofdioksied te behandel.[4]
Karbamate ontstaan ook deur alkoholise van chloorformamiede:[5]
En ook deur die reaksie van chloorformate en amiene:[6]
Natuurlike voorkoms
[wysig | wysig bron]In die natuur kan koolstofdioksied met neutrale amiengroepe bind om 'n karbamaat te vorm. Hierdie proses word karbamilering genoem.
Hemoglobien
[wysig | wysig bron]Die N-terminale amienogroepe van oorblyfsels van valien in die α- en β-kettings van deoksihemoglobien bestaan as karbamate. Dit help om die proteïen te stabiliseer wanneer dit deoksihemoglobien word, en verhoog die waarskynlikheid van die vrystelling van oorblywende suurstofmolekules wat aan die proteïen gebind is.[7]
Urose en fosfotriesterase
[wysig | wysig bron]Die ε-aminogroepe van oorblyfsels van die aminosuur lisien in urose en fosfotriesterase bevat ook karbamaat. Die karbamaat afgelei van amienoimidasool is 'n intermediêr in die biosintese van die nukliosied inosien (wat in RNS voorkom).[8]
CO2-opvang in plante
[wysig | wysig bron]Die belangrikste karbamaat is die wat betrokke is by die opvang van CO2 deur plante, wat nodig is vir die groei daarvan. Die ensiem ribuloos-1,5-bisfosfaatkarboksilaas/oksigenaas (RuBisCO) heg 'n molekule koolstofdioksied as fosfogliseraat aan. In die ensiem is 'n Mg2+-ioon gebind aan oorblyfsels van glutamaat, asparaat en lisienkarbamaat.[9]
Industriële gebruike
[wysig | wysig bron]Industriële gebruike sluit in die produksie van ureum uit ammoniak en koolstofdioksied,[10] vervaardiging van poliuretaan plastiek, plaagdoders (en chemiese wapens), preserveermiddels en skoonheidsmiddels,[11] en medisyne.[12]
Plaagdoders en chemiese wapens
[wysig | wysig bron]
Daar is verskeie insekdoders wat die karbamaatester funksionele groep het, insluitend bekende verbindings soos aldikarb. Hierdie insekdoders maak gewoonlik insekte dood deur die ensiem asetielkolienesteraas wat betrokke is by die werking van neuro-oordragstowwe, te deaktiveer. Organofosfaatplaagdoders werk op amper dieselfde manier. Sulke plaagdoders kan gevaarlik wees vir beide insekte en soogdiere, insluitend mense.[13][Nota 1]
Alhoewel die karbamaat-asetielcholienesterase-inhibeerders algemeen "karbamaat-insekdoders" genoem word, het hulle sterk selektiwiteit vir insekasetielcholienesterase-ensieme bo die soogdierweergawes, maar die sterkste verbindings soos aldikarb en karbofuraan is steeds in staat om soogdier-asielcholinesterase-ensieme teen lae genoeg konsentrasies te inhibeer dat dit 'n beduidende risiko vir vergiftiging vir mense inhou, veral as dit in groot hoeveelhede vir landboutoepassings gebruik word. Ander asetielcholienesterase-inhibeerders gebaseer op karbamaat, is bekend met 'n nog groter toksisiteit vir mense, en sommige is ondersoek vir moontlike militêre gebruik as senuweemiddels. Daar is egter nie gevind dat hulle geskik is vir gebruik as chemiese wapens nie.[14][15]
Aantekeninge
[wysig | wysig bron]- ↑ RoundupTM (glifosaat) is egter nie 'n organofosfaat nie, maar 'n organofosfonaat. Studies in rotte en honde het bevestig dat glifosaat nie koliensteraas inhibeer nie, wat dit veilig maak vir mense.[16] Glifosaat kom voor in die onkruiddoder Two StepTM waar, in die aktiveerende teenwoordigheid van triasien, getoon is dat dit wel koliensteraas inhibeer en dus giftig is vir insekte en soogdiere.[17]
Verwysings
[wysig | wysig bron]- ↑ 1,0 1,1 Burrows, George H.; Lewis, Gilbert N. (1912). "The equilibrium between ammonium carbonate and ammonium carbamate in aqueous solution at 25°". Journal of the American Chemical Society (in Engels). 34 (8): 993–995. doi:10.1021/ja02209a003.
- ↑ Clark, K. G.; Gaddy, V. L.; Rist, C. E. (1933). "Equilibria in the Ammonium Carbamate-Urea-Water System". Ind. Eng. Chem. (in Engels). 25 (10): 1092–1096. doi:10.1021/ie50286a008.
- ↑ Mani, Fabrizio; Peruzzini, Maurizio; Stoppioni, Piero (2006). "CO2 absorption by aqueous NH3 solutions: speciation of ammonium carbamate, bicarbonate and carbonate by a 13C NMR study". Green Chemistry (in Engels). Royal Society of Chemistry (RSC). 8 (11): 995. doi:10.1039/b602051h. ISSN 1463-9262.
- ↑ Brooks, L. A.; Audrieta, L. F.; Bluestone, H.; Jofinsox, W. C. (1946). Ammonium Carbamate. pp. 85–86. doi:10.1002/9780470132333.ch23. ISBN 9780470132333.
{{cite book}}:|journal=ignored (hulp) - ↑ Alizadeh, Babak Heidary; SUGIYAMA, Takeyoshi; ORITANI, Takayuki; KUWAHARA, Shigefumi (2002). "Preparation of N-Substituted Aryl and Alkyl Carbamates and Their Inhibitory Effect on Oat Seed Germination". Bioscience, Biotechnology, and Biochemistry (in Engels). Oxford University Press (OUP). 66 (2): 422–425. doi:10.1271/bbb.66.422. ISSN 0916-8451.
- ↑ Chaturvedi, Devdutt (1 Mei 2011). "Recent Developments on the Carbamation of Amines". Current Organic Chemistry (in Engels). Bentham Science Publishers Ltd. 15 (10): 1593–1624. doi:10.2174/138527211795378173. ISSN 1385-2728.
- ↑ Ferguson, J. K. W.; Roughton, F. J. W. (14 Desember 1934). "The direct chemical estimation of carbamino compounds of CO2 with hæmoglobin". The Journal of Physiology (in Engels). 83 (1): 68–86. doi:10.1113/jphysiol.1934.sp003212. ISSN 0022-3751. PMC 1394306. PMID 16994615.
- ↑ Bartoschek, S.; Vorholt, J. A.; Thauer, R. K.; Geierstanger, B. H.; Griesinger, C. (2001). "N-Carboxymethanofuran (carbamate) formation from methanofuran and CO2 in methanogenic archaea: Thermodynamics and kinetics of the spontaneous reaction". Eur. J. Biochem. (in Engels). 267 (11): 3130–3138. doi:10.1046/j.1432-1327.2000.01331.x. PMID 10824097.
- ↑ Lundqvist, T; Schneider, G (29 Januarie 1991). "Crystal Structure of the Ternary Complex of ribulose-1,5-bisphosphate Carboxylase, Mg(II), and Activator CO2 at 2.3-A Resolution". Biochemistry (in Engels). 30 (4): 904–8. doi:10.1021/bi00218a004. PMID 1899197.
- ↑ Krase, N. W.; Gaddy, V. L. (1 Julie 1922). "Synthesis of Urea from Ammonia and Carbon Dioxide". Journal of Industrial & Engineering Chemistry (in Engels). American Chemical Society (ACS). 14 (7): 611–615. doi:10.1021/ie50151a009. ISSN 0095-9014.
- ↑ Badreshia, S. (2002). "Iodopropynyl butylcarbamate". Am. J. Contact Dermatitis (in Engels). 13 (2): 77–79. doi:10.1053/ajcd.2002.30728. ISSN 1046-199X. PMID 12022126.
- ↑ Holland, J. R.; Hosley, H.; Scharlau, C.; Carbone, P. P.; Frei, E., III; Brindley, C. O.; Hall, T. C.; Shnider, B. I.; Gold, G. L.; Lasagna, L.; Owens, A. H., Jr; Miller, S. P. (1 Maart 1966). "A controlled trial of urethane treatment in multiple myeloma". Blood (in Engels). 27 (3): 328–42. doi:10.1182/blood.V27.3.328.328. ISSN 0006-4971. PMID 5933438.
{{cite journal}}: AS1-onderhoud: meer as een naam (link) - ↑ Fukuto, T. R. (1990). "Mechanism of action of organophosphorus and carbamate insecticides". Environmental Health Perspectives (in Engels). 87: 245–254. doi:10.1289/ehp.9087245. PMC 1567830. PMID 2176588.
- ↑ Gupta, Ramesh C., red. (2015). Handbook of Toxicology of Chemical Warfare Agents (in Engels). Cambridge, Massachusetts, USA: Academic Press. pp. 338–339. ISBN 9780128004944.
- ↑ Ellison, D (2008). Handbook of chemical and biological warfare agents (in Engels). Boca Raton: CRC Press. ISBN 978-0-8493-1434-6. OCLC 82473582.
- ↑ "GLYPHOSATE - NOT AN ORGANOPHOSPHATE" (pdf) (in Engels). baumhedlundlaw.com. Besoek op 5 April 2021.
- ↑ Schuler, L. J.; Trimble, A. J.; Belden, J. B.; Lydy, M. J. (28 Junie 2005). "Joint Toxicity of Triazine Herbicides and Organophosphate Insecticides to the Midge Chironomus tentans". Archives of Environmental Contamination and Toxicology (in Engels). Springer Science and Business Media LLC. 49 (2): 173–177. doi:10.1007/s00244-004-0224-8. ISSN 0090-4341.



![{\displaystyle {\ce {2 NH3 + CO2 -> NH4[H2NCO2]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0bbb83a03a9fca9558891af33db17b12fe34141d)

