Bensaldehied
|
Algemeen | |
|---|---|
| Naam | Bensaldehied |
 |
 |
| Chemiese formule | C6H5CHO |
| Molêre massa | 106.12 g/mol |
| CAS-nommer | 100-52-7 |
| Voorkoms | Kleurlose of liggeel vloeistof met sterk refraksie |
| Reuk | amandelagtig |
| Fasegedrag | |
| Smeltpunt | -57.12 °C |
| Kookpunt | 178.1 °C |
| Digtheid | 1.044 g/mL, vloeistof |
| Oplosbaarheid | 0.3 g/100 mL (20 °C)[1] |
| Viskositeit | 1.321 cP (25 °C) |
|
Suur-basis eienskappe | |
| pKa | |
|
Veiligheid | |
| Flitspunt | 64 °C |
| Selfontbrandingspunt | 192 °C |
| LD50 | 1300 mg/kg (rot, oraal) |
|
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
Bensaldehied (C6H5CHO), is 'n organiese verbinding wat bestaan uit 'n benseenring met 'n formielsubstituent. Dit is die eenvoudigste aromatiese aldehied, en het baie industriële toepassings.
Dit is 'n kleurlose vloeistof met 'n kenmerkende reuk van amandels. Bensaldehied is die primêre komponent van bitter amandelolie, en kan uit 'n verskeidenheid natuurlike bronne geëkstraheer word.[2] Sintetiese bensaldehied is die geur in nagemaakte amandelekstrak, wat algemeen in gebakte produkte gebruik word.[3]
Geskiedenis
[wysig | wysig bron]Bensaldehied is in 1803 deur die Franse apteker Martrès vir die eerste keer uit bitter amandels geëkstraheer.[4] In 1832 het die Duitse chemici Friedrich Wöhler en Justus von Liebig bensaldehied vir die eerste keer gesintetiseer.[5]
Produksie
[wysig | wysig bron]Teen 1999 is 7000 ton sintetiese, en 100 ton natuurlike bensaldehied jaarliks geproduseer.[6] Vloeistoffase chlorinering en oksidasie van tolueen is die belangrikste sintetiese roetes. Talle ander metodes is ook al ontwikkel, soos byvoorbeeld die gedeeltelike oksidasie van bensielalkohol, alkaliese hidrolise van bensalchloried, en karbonilering van benseen.[7]
'n Beduidende hoeveelheid van natuurlike bensaldehied word verkry deur die retro-aldol reaksie uit te voer op kaneelaldehied afkomstig van cassia-olie: die kaneelaldehied word in 'n waterige/alkoholiese oplossing tussen 90 °C en 150 °C met 'n basis (mees algemeen natriumkarbonaat (soda) of koeksoda) vir 5 tot 80 uur onder reflux verhit,[8] en die gevormde bensaldehied word vervolgens deur distillasie gesuiwer. Hierdie reaksie lewer ook asetaldehied. Die natuurlike status van bensaldehied wat op hierdie manier verkry word, is omstrede.
Setel-spesifieke KMR-spektroskopie, wat 1H/2H isotoopverhoudings kan bepaal, word gebruik om te onderskei tussen natuurlike en sintetiese bensaldehied.[9]
Voorkoms
[wysig | wysig bron]Bensaldehied en soortgelyke chemikalieë kom natuurlik in baie voedselsoorte voor. Die meeste van die bensaldehied wat mense eet is van natuurlike plantaardige voedsel soos amandels afkomstig.[10]
Die pitte van amandels, appelkose, appels en kersies bevat beduidende hoeveelhede van amygdalin. Hierdie glikosiedverbinding word deur ensieme in bensaldehied, blousuur en twee molekules van glukose afgebreek.
Bensaldehied dra by tot die geur van oestersampioene (Pleurotus ostreatus).[11]
Reaksies
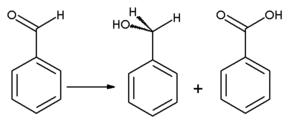
[wysig | wysig bron]Bensaldehied kan deur oksidasie in bensoësuur omgeskakel word, 'n reuklose verbinding wat 'n algemene onsuiwerheid in laboratoriummonsters is. Bensielalkohol kan deur hidrogenasie uit bensaldehied gevorm word. Reaksie van bensaldehied met watervrye natriumasetaat en asynsuuranhidried lewer kaneelsuur, terwyl alkoholiese kaliumsianied gebruik kan word om die kondensasie van bensaldehied na bensoïen te kataliseer. Bensaldehied ondergaan disproporsionering onder inwerking van gekonsentreerde alkali in die Cannizzaro reaksie: een molekuul van die aldehied word tot die ooreenstemmende alkohol gereduseer, terwyl 'n ander molekule geoksideer word tot bensoaat.
Gebruik
[wysig | wysig bron]Bensaldehied word algemeen gebruik om amandelgeur aan kos en gegeurde produkte te verleen. Dit word soms ook in skoonheidsprodukte gebruik.[12]
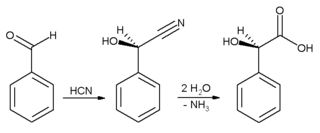
In industriële toepassings word bensaldehied hoofsaaklik as 'n voorloper tot ander organiese verbindings gebruik, vanaf farmaseutiese produkte tot plastiekbymiddels. Die anilienkleurstof malachietgroen word byvoorbeeld vanaf bensaldehied en dimetielanilien geproduseer. Bensaldehied is ook 'n voorloper tot sekere akridienkleurstowwe. Via aldolkondensasies, word bensaldehied in afgeleides van kaneelaldehied en stireen omgeskakel. Die sintese van mandelsuur begin met bensaldehied:
Blousuur word eers by bensaldehied gevoeg, en die nitriel wat so geproduseer word, word vervolgens gehidroliseer om mandelsuur te vorm. Die skema hierbo toon slegs een van die twee gevormde enantiomere.
Nis gebruike
[wysig | wysig bron]Bensaldehied word as 'n afweerder vir heuningbye gebruik.[13] 'n Klein hoeveelheid bensaldehiedoplossing word op 'n rookblad naby die heuningkoeke aangebring. Die bye beweeg dan weg om die dampe te vermy.[14] Die byeboer kan dan die heuningrame van die byekorf verwyder met minder risiko vir beide bye en byeboer.
Veiligheid
[wysig | wysig bron]In voedsel, skoonheidsmiddels, farmaseutiese produkte, en seep, word bensaldehied oor die algemeen beskou as veilig, en het derhalwe die status "Generally Recognized As Safe" (GRAS) vanaf die Amerikaanse Food and Drug Aministration (FDA).[15] Hierdie status is bevestig na 'n hersiening in 2005. Dit word ook in die Europese Unie as 'n geurmiddel aanvaar. Toksikologiese studies dui daarop dat dit, in die konsentrasies wat in voedsel en skoonheidsmiddels gebruik word, veilig is en nie kankerwekkend is nie, en mag selfs karsinostatiese (anti-kanker) eienskappe hê.
In hoë konsentrasies soos by industriële toepassings, kan bensaldehied egter gevaarlik wees. Vir 'n 70 kg mens, word die dodelike dosis geskat op 50 mL. 'n Aanvaarbare daaglikse inname van 15 mg/dag is deur die Verenigde State se Environmental Protection Agency vasgelê.[16] Bensaldehied akkumuleer nie in menslike weefsel nie: dit word gemetaboliseer en dan in die urine uitgeskei.
Verwysings
[wysig | wysig bron]- ↑ "GESTIS Substance database". Institute for Occupational Safety and Health of the German Social Accident Insurance. Geargiveer vanaf die oorspronklike op 3 Maart 2016. Besoek op 21 Augustus 2012.
- ↑ http://www.freepatentsonline.com/1416128.pdf, United States Patent 1416128 – Process of treating nut kernels to produce food ingredients.
- ↑ Illustrated, Cook's (1 Oktober 2013). The Cook's Illustrated Baking Book (in Engels). America's Test Kitchen. ISBN 978-1-936493-78-4.
- ↑ In 1803 C. Martrès published a manuscript on the oil of bitter almonds: "Recherches sur la nature et le siège de l'amertume et de l'odeur des amandes amères" (Research on the nature and location of the bitterness and the smell of bitter almonds). However, the memoir was largely ignored until an extract was published in 1819: Martrès fils (1819) "Sur les amandes amères," Journal de Pharmacie, vol. 5, pages 289-296.
- ↑ Wöhler and Liebig (1832) "Untersuchungen über das Radikal der Benzoesäure" (Investigations of the radical of benzoic acid), Annalen der Pharmacie, vol. 3, pages 249-282.
- ↑ Passos, Maria Laura., Ribeiro, Claudio P., red. (2010). Innovation in food engineering : new techniques and products. Boca Raton, FL: CRC Press. p. 87. ISBN 978-1-4200-8607-2. OCLC 500683261.
{{cite book}}: AS1-onderhoud: meer as een naam (link) - ↑ Friedrich Brühne and Elaine Wright “Benzaldehyde” in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a03_463
- ↑ http://www.patentstorm.us/patents/pdfs/patent_id/4617419.html[dooie skakel], Process for preparing natural benzaldehyde and acetaldehyde, natural benzaldehyde and acetaldehyde compositions, products produced thereby and organoleptic utilities therefor, Charles Wienes, Middletown; Alan O. Pittet, Atlantic Highlands, both of N.J.
- ↑ Ashurst, Philip R. (11 November 2013). Food Authentication (in Engels). Springer Science & Business Media. p. 274. ISBN 978-1-4613-1119-5.
- ↑ Adams, T. B. (1 Augustus 2005). "The FEMA GRAS assessment of benzyl derivatives used as flavor ingredients". Food and Chemical Toxicology. 43 (8): 1207–1240. doi:10.1016/j.fct.2004.11.014.
- ↑ Beltran-Garcia, Miguel J. (1997). "Volatile Compounds Secreted by the Oyster Mushroom (Pleurotus ostreatus)and Their Antibacterial Activities". Journal of Agricultural and Food Chemistry. 45 (10): 4049. doi:10.1021/jf960876i.
- ↑ Andersen, Alan (1 Januarie 2006). "Final report on the safety assessment of benzaldehyde". International Journal of Toxicology. 25 Suppl 1: 11–27. doi:10.1080/10915810600716612.
- ↑ Evans, Elizabeth (9 Februarie 2010). Why Do Bees Buzz?: Why Do Bees Buzz? Fascinating Answers to Questions about Bees (in Engels). Rutgers University Press. pp. 177–178. ISBN 978-0-8135-4920-0.
- ↑ Sanford, Malcolm T. (1 Januarie 2010). Storey's Guide to Keeping Honey Bees: Honey Production, Pollination, Bee Health (in Engels). Storey Publishing. p. 167. ISBN 978-1-60342-550-6.
- ↑ Friedrich Brühne; Elaine Wright (2007), "Benzaldehyde", Ullmann's Encyclopedia of Industrial Chemistry (7th ed.), Wiley, p. 11
- ↑ https://cfpub.epa.gov/ncea/risk/recordisplay.cfm?deid=41551.