Periodieke tabel


Die periodieke tabel is 'n voorstelling van die bekende chemiese elemente, gerangskik volgens hul atoomgetal, elektronkonfigurasie en chemiese eienskappe. Elemente word gerangskik volgens toenemende atoomgetal (die getal protone). Die standaardvorm van die tabel bestaan uit ’n rooster van 18 x 7 blokkies, wat die hoofdeel vorm, plus ’n kleiner deel van twee rye onderaan.
Die tabel kan ook verdeel word in vier reghoekige blokke: die s-blok links, die p-blok regs, die d-blok in die middel en die f-blok daaronder. Die rye van die tabel word periodes genoem en die kolomme van die s-, d- en p-blok groepe; sommige van hulle het name soos halogene of edelgasse. Aangesien die periodieke tabel chemiese tendense behels, kan dit gebruik word om die verhouding tussen eienskappe van die elemente af te lei en om die eienskappe van nuwe, nog onontdekte elemente of sinteties vervaardigde elemente te voorspel.
Hoewel periodieke tabelle vantevore bestaan het, word Dmitri Mendelejef oor die algemeen beskou as die vader van die huidige tabel, wat hy in 1869 gepubliseer het. Dit is die eerste een wat algemeen aanvaar is. Hy het die tabel ontwikkel om tendense in die eienskappe van die destyds bekende elemente te illustreer. Hy het ook van die eienskappe van toe nog onbekende elemente voorspel na aanleiding van leë ruimtes in die tabel. Die meeste van sy voorspellings het korrek blyk te wees toe dié elemente later ontdek is. Mendelejef se periodieke tabel is sedertdien uitgebrei en verfyn met die ontdekking of sintetiese vervaardiging van nog nuwe elemente en die ontwikkeling van nuwe teoretiese modelle om chemiese gedrag te verduidelik.
Alle elemente van 1 (waterstof) tot 118 (oganesson) is al ontdek of sinteties vervaardig. Die elemente van 1 tot 98 (kalifornium) bestaan natuurlik, hoewel sommige net in klein hoeveelhede voorkom en aanvanklik ontdek is toe hulle sinteties vervaardig is. Die elemente ná 98 is sinteties vervaardig in laboratoriums. Die vervaardiging van elemente ná oganesson word beplan en voortdurende debatte word gevoer oor hoe die periodieke tabel verander sal moet word as enige sulke elemente bykom.
Uitleg
So lyk die huidige periodieke tabel van bekende chemiese elemente. Elemente waarvan die atoomgetal in rooi aangedui word, is sinteties vervaardig. Die eienskappe van elemente op ’n liggrys agtergrond is onbekend.
| Groep → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| ↓ Periode | ||||||||||||||||||||
| 1 | 1 H |
2 He | ||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | ||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | ||
| 6 | 55 Cs |
56 Ba |
* |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | ||
| 7 | 87 Fr |
88 Ra |
* * |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | ||
| * Lantaniede | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | |||||
| * * Aktiniede | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | |||||
| Alkalimetale | Aardalkalimetale | Lantaniede | Aktiniede | Oorgangsmetale |
| Hoofgroepmetale | Metalloïdes | Niemetale | Halogene | Edelgasse |
Alle weergawes van die periodieke tabel bevat net chemiese elemente, nie samestellings of elementêre deeltjies nie. Elke chemiese element het ’n unieke atoomgetal wat ooreenstem met die getal protone in sy kern. Die meeste elemente het ’n verskillende aantal neutrone in verskillende atome, en dié variasies word isotope genoem. Koolstof het byvoorbeeld drie isotope wat in die natuur voorkom: al sy atome het ses protone en die meeste het ook ses neutrone, maar sowat 1 persent het sewe neutrone en ’n baie klein aantal het agt neutrone. Isotope word nooit apart in periodieke tabelle aangetoon nie; hulle word altyd saam as een element gegroepeer.
In die standaardmodel word die elemente gelys in volgorde van toenemende atoomgetalle. ’n Nuwe periode (ry) begin wanneer ’n nuwe elektronskil sy eerste elektron het. Groepe (kolomme) word bepaal deur die elektronkonfigurasie van die atoom; elemente met dieselfde getal elektrone in ’n spesifieke subskil val in dieselfde kolom (suurstof en seleen is byvoorbeeld in dieselfde kolom omdat albei vier elektrone in die buitenste p-subskil het). Elemente met soortgelyke chemiese eienskappe val gewoonlik in dieselfde groep in die periodieke tabel, hoewel elemente in dieselfde periode in die f-blok, en in ’n mate in die d-blok, geneig is om ook soortgelyke eienskappe te hê. Dit is dus relatief maklik om die chemiese eienskappe van ’n element te voorspel as die eienskappe van die omringende elemente bekend is.[1]
Sedert 2012 bevat die periodieke tabel 118 bevestigde chemiese elemente. Altesaam 98 kom in die natuur voor, waarvan 84 oorspronklik is. Die ander 14 natuurlike elemente kom net voor in vervalreekse van oorspronklike elemente.[2] Alle elemente van einsteinium (99) tot oganesson (118) word erken al is hulle sinteties vervaardig en kom hulle nie in die natuur voor nie.
Groepering
Groepe
’n "Groep" of "familie" is ’n vertikale kolom in die periodieke tabel. Elemente in dieselfde groep het ooreenstemmende chemiese eienskappe. Byvoorbeeld die verbindings met waterstof in kolom 17 het die formule HX: HF, HCl, HBr, HI, terwyl in kolom 16 dit juis H2X is: H2O, H2S, H2Se, H2Te. In een kolom toon van die eienskappe ’n duidelike tendens met die toename van die atoomgetal.[3] In sommige dele van die tabel, soos in die d- en f-blok, kan horisontale ooreenkomste egter net so belangrik of duideliker wees as vertikale ooreenkomste.[4][5][6]
Die groepe word van 1-18 genommer, van die linkerkantse kolom (die alkalimetale) tot die regterkantse kolom (die edelgasse).[7] Voorheen is hulle in Romeinse syfers gemerk.
Elemente in dieselfde groep neig om patrone te toon in atoomradius, ionisasie-energie en elektronegatiwiteit. Van bo na onder in ’n groep neem die atoomradius van die elemente toe; elektrone kom dus verder van die kern af voor. Van bo na onder neem die ionisasie-energie af, want dit is makliker om ’n elektron te verwyder omdat die atome se verbinding nie so sterk is nie. Net so neem elektronegatiwiteit af van bo na onder.[8] Daar is egter uitsonderings op die reël, soos in groep 11, waar die elektronegatiwiteit verder af in die groep toeneem.
Periodes
’n "Periode" is ’n horisontale ry in die periodieke tabel. Hoewel vertikale ooreenkomste gewoonlik groter is, is daar dele van die tabel waar die horisontale ooreenkomste groter is, soos in die f-blok, waar die lantaniede en aktiniede twee duidelike horisontale reekse elemente is.[9]

Elemente in dieselfde periode toon tendense in die atoomradius, ionisasie-energie en elektronegatiwiteit. Van links na regs in die tabel neem die atoomradius gewoonlik af. Dit gebeur omdat elke opeenvolgende element ’n bykomende proton en elektron het, wat veroorsaak dat die elektron meer deur die kern aangetrek word.[10] Dit veroorsaak dat die ionisasie-energie van links na regs toeneem: hoe meer die elektrone deur die kern aangetrek word, hoe meer energie is nodig om ’n elektron te verwyder. Net so neem elektronegatiwiteit van links na regs toe.[8] Elektronaffiniteit toon ook ’n tendens. Metale (links) het gewoonlik ’n laer elektronaffiniteit as die nie-metale (regs), met die uitsondering van die edelgasse.[11]
Blokke
Vanweë die belangrikheid van die buitenste elektronskil word die verskillende areas van die periodieke tabel soms "blokke" genoem, waarvan die name verwys na die subskil met die "laaste" elektron. Die s-blok bevat die eerste twee groepe (alkalimetale en aardalkalimetale) sowel as waterstof en helium. Die p-blok bevat die laaste ses groepe: van 13 tot 18, onder meer die metalloïdes. Die d-blok bevat groep 3 tot 12, onder meer al die oorgangsmetale. Die f-blok, wat gewoonlik onderaan die res van die tabel aangetoon word, bevat die lantaniede en aktiniede.[12]
Variasies
Die lantaniede en aktiniede word gewoonlik onderaan die res van die periodieke tabel aangetoon.[13] Dit is bloot om estetiese en praktiese redes. Hulle kan ook deel van die hooftabel vorm en op hul regte plek as deel van die sesde en sewende periode ingevoeg word om ’n breë tabel te vorm, soos onder aangedui.
 |
 |
| Periodieke tabel met die f-blok apart (links) en as deel van die hooftabel (regs). | |
Periodieke eienskappe
Talle eienskappe van die elemente, soos die atoomradius, die ionisasie-energie, die elektronegativiteit, die smeltpunte en so meer vertoon 'n periodieke gedrag en die tabel kan gebruik word om dit in kaart te bring.
Elektronegativiteit
Hierdie belangrike kenmerk van 'n element se eienskappe bepaal hoofsaaklik watter bindings die element met ander elemente kan vorm. Langs die hoofdiagonaal van frankium (linksonder) na fluoor (regsbo) neem die waarde van die elektronegatiwiteit toe, maar daar is ook party eilande met taamlik hoë waardes (sien wolfram, goud, lood).
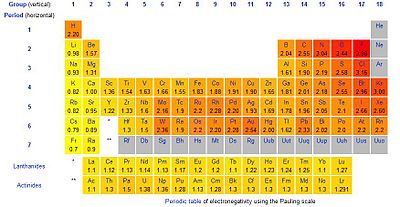
Smeltpunt
Veral in die d-blok kan elemente 'm hoë smeltpunt bereik maar die diagonale groep van die metalloïede het ook hoë smeltpunte.

Geskiedenis
Die periodieke tabel is oorspronklik ontwerp sonder kennis van die inwendige bou van die atoom. Die elemente is gerangskik volgens hul atoommassa. Die Duitser Johann Wolfgang Döberreiner was die eerste wat opgemerk het dat daar ’n golfbeweging ontstaan het in die eienskappe. Hy het triade van ooreenkomstige elemente onderskei. Die Engelsman John Alexander Reina Newlands het ontdek daar bestaan ’n reëlmatigheid in elke 8 elemente, maar hy is bespot toe hy die vermoede uitspreek dat dit vergelykbaar met die oktawe in musiek kon wees. Uiteindelik het die Duitser Lothar Meyer en die Rus Dmitri Mendelejef die eerste perodieke tabel gepubliseer. Daarby het hulle die massa van telluur en jodium omgeruil. Dit het die ooreenstemming van tendense verbeter. Ná die koms van die golfmeganika het dit duidelik geword dat hierdie stap geregverdig was.
Sien ook
Verwysings
- ↑ Gray, p. 6
- ↑ Emsley, John (2011). Nature's Building Blocks: An A-Z Guide to the Elements (New uitg.). New York, NY: Oxford University Press. ISBN 978-0-19-960563-7.
- ↑ Messler, R. W. (2010). The essence of materials for engineers. Sudbury, MA: Jones & Bartlett Publishers. p. 32. ISBN 0-7637-7833-8.
- ↑ Bagnall, K. W. (1967), "Recent advances in actinide and lanthanide chemistry", in Fields, PR; Moeller, T, Advances in chemistry, Lanthanide/Actinide chemistry, 71, American Chemical Society, pp. 1–12, doi:10.1021/ba-1967-0071
- ↑ Day, M. C.; Selbin, J. (1969). Theoretical inorganic chemistry (2de uitg.). New York, MA: Reinhold Book Corporation. p. 103. ISBN 0-7637-7833-8.
- ↑ Holman, J.; Hill, G. C. (2000). Chemistry in context (5de uitg.). Walton-on-Thames: Nelson Thornes. p. 40. ISBN 0-17-448276-0.
- ↑ Leigh, G. J. (1990). Nomenclature of Inorganic Chemistry: Recommendations 1990. Blackwell Science. ISBN 0-632-02494-1.
- ↑ 8,0 8,1 Moore, p. 111
- ↑ Stoker, Stephen H. (2007). General, organic, and biological chemistry. New York: Houghton Mifflin. p. 68. ISBN 978-0-618-73063-6. OCLC 52445586.
- ↑ Mascetta, Joseph (2003). Chemistry The Easy Way (4th uitg.). New York: Hauppauge. p. 50. ISBN 978-0-7641-1978-1. OCLC 52047235.
- ↑ Kotz, John; Treichel, Paul; Townsend, John (2009). Chemistry and Chemical Reactivity, Volume 2 (7de uitg.). Belmont: Thomson Brooks/Cole. p. 324. ISBN 978-0-495-38712-1. OCLC 220756597.
- ↑ Jones, Chris (2002). d- and f-block chemistry. New York: J. Wiley & Sons. p. 2. ISBN 978-0-471-22476-1. OCLC 300468713.
- ↑ Gray, p. 11
Bibliografie
- Ball, Philip (2002). The Ingredients: A Guided Tour of the Elements. Oxford: Oxford University Press. ISBN 0-19-284100-9.
- Chang, Raymond (2002). Chemistry (7th uitg.). New York: McGraw-Hill Higher Education. ISBN 0-07-112072-6.
- Gray, Theodore (2009). The Elements: A Visual Exploration of Every Known Atom in the Universe. New York: Black Dog & Leventhal Publishers. ISBN 978-1-57912-814-2.
- Huheey, JE; Keiter, EA; Keiter, RL. Principles of structure and reactivity (4th uitg.). New York: Harper Collins College Publishers. ISBN 0-06-042995-X.
- Moore, John (2003). Chemistry for Dummies. New York: Wiley Publications. p. 111. ISBN 978-0-7645-5430-8. OCLC 51168057.
- Scerri, Eric (2007). The periodic table: Its story and its significance. Oxford: Oxford University Press. ISBN 0-19-530573-6.
- Scerri, Eric R. (2011). The periodic table: A very short introduction. Oxford: Oxford University Press. ISBN 978-0-19-958249-5.
- Venable, F P (1896). The development of the periodic law. Easton PA: Chemical Publishing Company.
Eksterne skakels
 Wikiwoordeboek het 'n inskrywing vir periodieke tabel.
Wikiwoordeboek het 'n inskrywing vir periodieke tabel.- Chemistry: Web Elements (en)
- 'n Weergawe van die periodieke tabel vir magnetiese resonansie. (en)
- Kook- en smeltpunte van die elemente (Afrikaans)
- Interaktiewe periodieke tabel (Afrikaans)
